
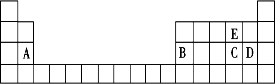
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、﹣2 | ﹣1 | ﹣2 |
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分). 
(2)B元素处于元素周期表中周期族;
(3)在元素周期表中的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是(填化学式);
(5)C和E形成的化合物M,能使酸性高锰酸钾溶液褪色,体现了M的性.
(6)写出D与强碱溶液反应的离子方程式 .
【答案】
(1)
(2)第三;第ⅢA
(3)金属与非金属
(4)HClO4
(5)还原
(6)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
【解析】解:原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,铍的原子半径为0.089nm,E的原子半径小于铍且其最低负价是﹣2,元素的最低负价=其最外层电子数﹣8,所以E位于第VIA族,为O元素,这几种元素都是短周期元素,原子半径大小顺序是A>B>C>D,这几种元素的原子半径都大于铍原子,则为第三周期元素,结合其主要化合价知,A是Mg元素、B是Al元素、C是S元素、D是Cl元素,(1)Mg元素位于第三周期第IA族、Al元素位于第三周期第IIIA族、S位于第三周期第VIA族、Cl元素位于第三周期第VIIA、O元素位于第二周期第VIA族,所以答案是:  ;(2)元素原子核外电子层数等于其周期数,其最外层电子数等于其族序数,Al原子核外有3个电子层,最外层有3个电子,所以铝元素位于第三周期第IIIA族,所以答案是:第三;第ⅢA;(3)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素,所以答案是:金属与非金属;(4)最高价氧化物对应水化物分别为Mg(OH)2、Al(OH)3、H2SO4、HClO4 , 元素的非金属性越强,其最高价氧化物的水化物的酸性越强,但O元素没有正化合价,其次非金属性强的是Cl元素,所以酸性最强的酸是HClO4 , 所以答案是:HClO4;(5)S与O形成的化合物为SO2 , 可与高锰酸钾发生氧化还原反应,表现为还原性,所以答案是:还原;(6)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.
;(2)元素原子核外电子层数等于其周期数,其最外层电子数等于其族序数,Al原子核外有3个电子层,最外层有3个电子,所以铝元素位于第三周期第IIIA族,所以答案是:第三;第ⅢA;(3)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素,所以答案是:金属与非金属;(4)最高价氧化物对应水化物分别为Mg(OH)2、Al(OH)3、H2SO4、HClO4 , 元素的非金属性越强,其最高价氧化物的水化物的酸性越强,但O元素没有正化合价,其次非金属性强的是Cl元素,所以酸性最强的酸是HClO4 , 所以答案是:HClO4;(5)S与O形成的化合物为SO2 , 可与高锰酸钾发生氧化还原反应,表现为还原性,所以答案是:还原;(6)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】自然界中的能源可以分为一次能源和二次能源,一次能源是指直接取自自然界没有经过加工转换的各种能量和资源,由一次能源经过加工转换以后得到的能源产品,称为二次能源。下列叙述正确的是阶段( )
A. 电能是二次能源B. 水力是二次能源
C. 天然气是二次能源D. 水煤气是一次能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于指定粒子构成的叙述中,不正确的是( )
A.37Cl与39K具有相同的中子数
B.![]() He和
He和 ![]() He是两种不同的核素
He是两种不同的核素
C.H3O+与OH﹣具有相同的质子数和电子数
D.O22﹣与S2﹣具有相同的质子数和电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同,浓度均为0.1mol/L的NaOH溶液、氨水,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为
A. 4m=n B. m=n C. m<n D. m>n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为血红蛋白和肌红蛋白的活性部分﹣﹣血红素的结构式. 
回答下列问题:
(1)血红素中含有C,H,O,N,Fe五种元素,C,N,O三种元素的第一电离能由小到大的顺序是 , 写出基态Fe原子的核外电子排布式 .
(2)血红素中N原子的杂化方式为 , 在右图的方框内用“→”标出Fe2+的配位键.
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 , δ、α两种晶胞中铁原子的配位数之比为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇在生活中用途较多,下列关于乙醇的说法正确的是
A. 能与Na反应
B. 是食醋的主要成分
C. 能使红色石蕊试纸变蓝
D. 能与饱和Na2CO3溶液反应产生H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A. 2H++2e-=H2 B. Fe2++2e-=Fe
C. 2H2O+O2+4e-=4OH- D. Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用100ml 0.5molL﹣1Na2CO3溶液配制Na+浓度为0.20molL﹣1的溶液,下列操作正确的是( )
A.将该Na2CO3 溶液转移至250ml容量瓶中,加蒸馏水稀释至刻度线,摇匀
B.将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取150ml蒸馏水加入,搅拌
C.将该Na2CO3 溶液转移至250ml烧杯中,用量筒量取400ml蒸馏水加入,搅拌
D.将该Na2CO3 溶液转移至500ml容量瓶中,加蒸馏水稀释至刻度线,摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定量浓度的NaOH溶液,下列操作正确的是( )
A. 称量时,将NaOH固体放在右盘,砝码放在左盘
B. 将NaOH固体在烧杯中溶解,所得的溶液冷却至室温后,再转移到容量瓶中
C. 转移液体时,可以不用将洗涤液转至容量瓶
D. 定容时,可以俯视刻度线读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com