
【题目】体积相同,浓度均为0.1mol/L的NaOH溶液、氨水,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为
A. 4m=n B. m=n C. m<n D. m>n
科目:高中化学 来源: 题型:
【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有很大的价值. Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离. ①写出硫酸溶液与Fe2O3反应的离子方程式 .
②初步分离得到的滤渣主要成分是 .
(2)向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+ , 结合表分析其原因 .
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~8.95 | 1.94~3.20 | 3.69~4.8 |
(3)使用碱性较弱的氨水为pH调节剂,进行分离实验. ①氨水使滤液中铝离子沉淀的离子方程式为 .
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是 , 选择该范围的理由是 .
(4)Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3 . 已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是 .
2)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2 , 能将H2O2氧化。为了验证某小组学生设计了如下图所示的实验装置进行实验(夹持装置略去)。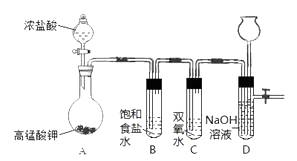
已知:2KMnO4+16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
试管B中饱和食盐水的主要作用是除去Cl2中混有的HCl
请回答下列问题。
(1)试管C发生反应的化学方程式是。
(2)试管D中NaOH溶液的作用是。
(3)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭D中止水夹,反应一段时间后试管D中的现象为 , 试管D中的气体检验方法为。
(4)有的同学对上述实验中D试管中的气体来源产生质疑,你认为可能的来源有(用方程式回答)。对于质疑可以采用对比实验来解决。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲 | 乙 | 丙 | 戊 | |
① | NH3 | O2 | NO | H2O |
② | Fe | H2O | H2 | Fe2O3 |
③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
④ | Na2O2 | CO2 | O2 | Na |

A.①③
B.②③
C.②④
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由N2、H2合成NH3 . 制备H2需经多步完成,其中“水煤气(CO、H2)变换”是纯化H2的关键一步.
(1)水煤气变换:CO(g)+H2O(g)CO2(g)+H2(g),平衡常数K随温度变化如表:
温度/℃ | 200 | 300 | 400 |
K | 290 | 39 | 11.7 |
①下列分析正确的是 .
a.水煤气变换反应的△H<0
b.增大压强,可以提高CO的平衡转化率
c.增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
②以氨水为吸收剂脱除CO2 . 当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程: .
(2)Fe3O4是水煤气变换反应的常用催化剂,经CO、H2还原Fe2O3制备.两次实验结果如表:
实验Ⅰ | 实验Ⅱ | |
通入气体 | CO、H2 | CO、H2、H2O(g) |
固体产物 | Fe3O4、Fe | Fe3O4 |
结合化学方程式解释H2O(g)的作用: .
(3)2016年我国某科研团队利用透氧膜,一步即获得N2、H2 , 工作原理如图所示.(空气中N2与O2的物质的量之比按4:1计) 
①起还原作用的物质是 .
②膜Ⅰ侧发生的电极反应式是 .
③膜Ⅰ侧所得气体 ![]() =3,CH4、H2O、O2反应的化学方程式是 .
=3,CH4、H2O、O2反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、﹣2 | ﹣1 | ﹣2 |
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分). 
(2)B元素处于元素周期表中周期族;
(3)在元素周期表中的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是(填化学式);
(5)C和E形成的化合物M,能使酸性高锰酸钾溶液褪色,体现了M的性.
(6)写出D与强碱溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能源是一种重要的清洁能源.现有两种可产生H2的化合物甲和乙.将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L的H2(已折算成标准状况).甲与水反应也能放出H2 , 同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液.化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25gL﹣1 . 请回答下列问题:
(1)甲的化学式是 .
(2)甲与水反应的化学方程式是 .
(3)气体丙与金属镁反应的产物是(用化学式表示).
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式 . 有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证(已知:Cu2O+2H+═Cu+Cu2++H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些重要工业生产的转化关系(反应条件略去):请完成下列问题: 
(1)若D是单质,且与A属于同一主族,反应在高温下进行,则: ①此反应的化学方程式是 .
②D单质的一种重要用途是 .
(2)若B为黄色固体,D为固体化合物,则该反应为4FeS2+11O2 ![]() 2Fe2O3+8SO2①当有1molC生成时,该反应转移电子的总数是 .
2Fe2O3+8SO2①当有1molC生成时,该反应转移电子的总数是 .
②将C通入足量的酸性KMnO4 溶液中,发生反应的离子方程式为 .
(3)若B是一种碱性气体,D为化合物,则: ①该反应的化学方程式是 .
②B在加热条件下与CuO反应有Cu生成,该反应的化学方程式为;有人提出产物Cu中可能还含有Cu2O.已知Cu+在酸性溶液中不能稳定存在,为验证Cu2O是否存在,可取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,则证明含有Cu2O.请写出发生反应的化学方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com