
【题目】美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数和核外电子数之差为 ( )
A.57B.47C.61D.293
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】阅读、分析下列两个材料:
材料一、
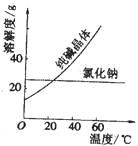
材料二、
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
乙二醇( C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 | B.萃取法 | C.“溶解、结晶、过滤”的方法 | D.分液法 |
(1) 将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用__________。
(2)将乙二醇和丙三醇相互分离的最佳方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、P、Cl、Fe等元素及其化合物有重要的应用,回答下列问题:
(1)C原子的价电子轨道表达式为__________________ 。
(2)CC14分子的空间构型是______________,其中心原子采取______________杂化,与CC14互为等电子体的一种离子是__________________ (填写离子符号)。
(3)PC13属于________________分子(填“极性”或“非极性”)。
(4)FeO、NiO的晶体结构均与NaCl晶体结构相同,其中Fe2+与Ni2+的离子半径分别为 7.8×l0-2nm、6.9×l0-2nm,则熔点 FeO_________NiO (填 “>”、“ <”或“=”),原因是___________________。
(5)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为______________。
(6)已知Fe单质有如图所示的两种常见堆积方式:

其中属于体心立方密堆积的是___________(填“a”或“b”);若单质Fe按a方式紧密堆积,原子半径为rpm,NA表示阿伏加德罗常数的值,则单质Fe的密度为________g·cm-3 (列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用KClO3在MnO2催化下受热分解制取氧气;从反应后的KCl和MnO2的混合物中分离、回收这两种物质。
(1)写出KClO3在MnO2催化下受热分解制取氧气的化学方程式:____________________;
(2)从KCl和MnO2的混合物中分离、回收这两种物质的实验方案如下:
![]()
步骤②的名称为______________,MnO2固体的洗涤方法______________________;
(3)步骤③的名称为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下Al2O3(s)+AlCl3(g)+3C(s) =3AlCl (g)+3CO(g) △H = a kJ·mol-1
3AlCl(g)=2Al(l)+ AlCl3 (g) △H = b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示)。
②Al4C3也是该反应过程中的一种中间产物。Al4C3 与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为_______________。
③甲烷和水反应可以制水煤气(混合气体),在恒温、固定体积为V升的密闭容器中的反应微观示意图如下所示,根据微观示意图得出的结论中,正确的是_____________。
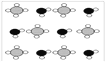
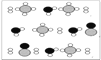
一定条件下经过t分钟达到化学平衡
a. 该反应方程式为:CH4+H2O = CO+3H2
b. 该反应平衡前后压强比为3:4
c. 该反应体系中含氢元素的化合物有3种
d. 该反应中甲烷的平衡转化率为50%
④水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac(aq) + CO(g) + NH3(g)![]() [Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是____________________。该条件下用气体表示的平衡常数表达式为:K=______________
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,一般在氩气环境中将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下可完全吸氢得到的混合物Y(含MgH2 和Al),Y在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________。
②写出镁铝合金(Mg17Al12 ) 在一定条件下完全吸氢的化学方程式 _________________。
③在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写为![]() .有机物X的键线式为:
.有机物X的键线式为:
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式_______________;
(2)Y在一定条件下发生聚合反应,写出其反应的化学方程式_______________________;
(3)二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它们的对应二甲苯的熔点分别为:
一溴代二甲苯 | 234℃ | 206℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
由以上数据推断:
熔点为234℃的一溴代二甲苯的结构简式为____________;熔点为-27℃的二甲苯的名称为____________;
II.治疗甲型H1N1流感的常见药物有奥司他韦、扎那米韦、金刚乙胺及金刚烷胺以及预防药物如中药材金银花、大青叶等。其中金刚烷胺可按下列路线合成:

已知狄尔斯阿德耳反应(也称双烯合成反应)如下所示:

试回答下列问题:
(1)B的结构式为________________(填键线式)。
(2)上述物质中,属于同分异构体的是________(填字母)。
(3)上述反应中,属于加成反应的是________(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个化学方程式并配平。
________+________===________+________+________+________H2O
(2)反应物中发生氧化反应的物质为________,被还原的元素是________。
(3)反应中1 mol氧化剂得到________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴滴涕是被禁用的有机污染物,它的结构简式如下,下列有关滴滴涕的说法正确的是

A. 它属于芳香烃 B. 分子中最少有24个原子共面
C. 分子式为C14H8Cl5 D. 能发生水解反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年9月,中国爆发三鹿毒奶粉事件,其原因是奶粉中含有三聚氰胺。三聚氰胺是一种重要的有机化工原料。它的结构简式如图,下列说法中正确的是

A. 该物质可用作食品添加剂
B. 三聚氰胺属于有机高分子化合物
C. 分子中所有原子都在同一平面上
D. 三聚氰胺含氮量很高,能冒充蛋白质通过检验
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com