
【题目】我国是世界上主要产钼国家之一,我国的钼资源十分丰富,以辉钼矿为主,是具有优势的战略资源。将辉钼矿精矿(主要成分为MoS2,杂质为CaCO3,SiO2,FeS2,CuFeS2,PbS等)除杂提纯可得到粗MoS2,通过精制转化最终可得到纯度更高的MoS2。
MoS2的相关信息:
①具有类似石墨的层状结构,有金属光泽,熔点1185℃,密度4.80g/cm-3,硬度很低,被广泛地应用在润滑领域。
②一般不溶于水、酸、碱和有机溶剂中,但溶于王水和煮沸的浓硫酸。Mo为+4价,在空气中加热至350℃以上开始被氧化,生成钼的氧化物。
有人提出了如下制取高纯MoS2的流程:

(1) MoS2可用作润滑添加剂的原因是:_____________。
(2)滤液1中存在的阳离子除H+、Ca2+、Pb2+外,还有:____________,写出“除杂1”过程发生的其中1个氧化还原反应的化学方程式:____________。
(3)“通空气并控温”这步操作的目的是:___________。必须控制好温度的原因:___________。
(4)“转化3”得到硫代钼酸铵(NH4)2MoS4。“转化4”中钼的化合价不变,产生气体和沉淀(二元化合物),写出该反应的离子方程式:____。
(5)上述流程中,哪些步骤发生了氧化还原反应:_____。
A.除杂1 B.除杂2 C.转化1 D.转化2 E.转化3 F.转化4 G.转化5
(6)上述流程中,可以循环使用的物质为(写化学式):_______。
【答案】具有类似石墨的层状结构,片层间作用力较小,层间易滑动 Fe2+、Cu2+、Fe3+ ![]() 或
或![]() 或
或![]() 利用空气将S氧化除去 温度过低,S被氧化速度太慢,温度过高,MoS2可能被氧化
利用空气将S氧化除去 温度过低,S被氧化速度太慢,温度过高,MoS2可能被氧化 ![]() ACG H2S或FeCl3
ACG H2S或FeCl3
【解析】
辉钼矿(主要含MoS2)用强酸性氯化铁酸浸,碳酸钙溶于酸为复分解反应,发生氧化还原反应有![]() 、
、![]() 、
、![]() ,加HF酸发生SiO2+4HF=SiF4↑+2H2O,通入空气并控制温除去S得到粗MoS2,空气中焙烧发生2MoS2+7O2
,加HF酸发生SiO2+4HF=SiF4↑+2H2O,通入空气并控制温除去S得到粗MoS2,空气中焙烧发生2MoS2+7O2![]() 4SO2+2MoO3,加入氨水发生MoO3+2NH3H2O=(NH4)2MoO4+H2O,生成(NH4)2MoO4,加入H2S、盐酸可得到MoS3,最后氢气还原MoS3生成高纯MoS2,以此来解答。
4SO2+2MoO3,加入氨水发生MoO3+2NH3H2O=(NH4)2MoO4+H2O,生成(NH4)2MoO4,加入H2S、盐酸可得到MoS3,最后氢气还原MoS3生成高纯MoS2,以此来解答。
(1)MoS2可用作润滑添加剂的原因是具有类似石墨的层状结构,片层间作用力较小,层间易滑动,
故答案为:具有类似石墨的层状结构,片层间作用力较小,层间易滑动;
(2)滤液1中存在的阳离子除H+、Ca2+、Pb2+外,还有Fe2+、Cu2+、Fe3+,写出“除杂1”过程发生的其中1个氧化还原反应的化学方程式为![]() 或
或![]() 或
或![]() ,
,
故答案为:Fe2+、Cu2+、Fe3+;![]() 或
或![]() 或
或![]() ;
;
(3)“通空气并控温”这步操作的目的是:利用空气将S氧化除去,必须控制好温度的原因为温度过低,S被氧化速度太慢,温度过高,MoS2可能被氧化,
故答案为:利用空气将S氧化除去;温度过低,S被氧化速度太慢,温度过高,MoS2可能被氧化;
(4)“转化4”中钼的化合价不变,产生气体和沉淀(二元化合物),该反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)由上述分析可知,除杂1、转化1、转化5均为氧化还原反应,故答案为:ACG;
(6)上述流程中,可以循环使用的物质为H2S或/span>FeCl3,故答案为:H2S或FeCl3。


 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.按照系统命名法,烃分子 的名称为2,3﹣二甲基﹣3﹣乙基戊烷
的名称为2,3﹣二甲基﹣3﹣乙基戊烷
B.鸡蛋白、大豆蛋白等蛋白质可溶于水,在这些蛋白质溶液中加入(NH4)2SO4或Na2SO4的浓溶液,可使蛋白质的溶解度降低而析出
C.![]() 可发生加成反应、取代反应、氧化反应
可发生加成反应、取代反应、氧化反应
D.有机物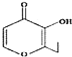 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
(俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | E | F | H | J | ||||
3 | B | C | D | G | I |
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是________,氧化性最强的单质是________,还原性最强的单质是________。
(2)最高价氧化物对应的水化物中,碱性最强的是________,酸性最强的是________,呈两性的是________。
(3)A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是________。
(4)在B、C、D、G、I中,原子半径最大的是________。
(5)元素C与I形成的化合物的电子式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一瓶无色澄清的溶液,其中可能含有H+、![]() 、Na+、Al3+、Fe3+、I-、
、Na+、Al3+、Fe3+、I-、![]() 、
、![]() 、
、![]() 、
、![]() 。取该溶液进行以下实验:
。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性 ②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色 ③该溶液的焰色反应没有黄色;根据以上实验结果,下列推断正确的是( )
A.向该溶液中加入BaCl2不一定能观察到白色沉淀
B.可以确定没有Na+、Fe3+、![]() 、
、![]() ,不能确定是否有
,不能确定是否有![]()
C.该溶液可能是NH4NO3与HI的混合
D.一定没有Al3+、![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成,据此判断,下列说法正确的是

A.上述反应不能说明钠比铜活泼
B.上述反应过程中只有一个氧化还原反应发生
C.加热且无水条件下,Na可以与CuSO4反应并生成Cu
D.依据上述反应可说明钠可以从任意铜盐溶液中置换出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯是热塑性材料,双酚A型聚碳酸酯的合成路线如下:
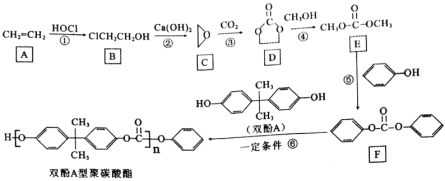
(1)B的化学名称为________,B中的官能团的名称是________。
(2)反应③的反应类型是________。
(3)写出D到E的反应方程式________。
(4)写出反应⑥中除生成双酚A型聚碳酸酯外的产物的结构简式________。
(5)写出满足下列条件的F的同分异构体的结构简式________(不考虑立体异构,只需写出2个)。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③核磁共振氢谱有六组峰
(6)设计由1-丙醇制备![]() 的合成路线________(无机试剂任选)。
的合成路线________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如下图所示,下列说法错误的是

A. 反应总过程ΔH<0
B. Fe+使反应的活化能减小
C. FeO+也是该反应的催化剂
D. Fe++N2O![]() FeO++N2、FeO++CO
FeO++N2、FeO++CO![]() Fe++CO2两步反应均为放热反应
Fe++CO2两步反应均为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com