
在1 L的密闭容器中,充入1 mo1CO和1 mo1 H2O (g),于850℃时进行化学反应:CO(g) + H2O (g)![]() CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
CO2(g) + H2(g) △H<0,达平衡时,有50%的CO转化为CO2。在相同温度下,将1 mo1CO和4 mo1 H2O (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
| 时间/min | n(CO)/ mo1 | n(H2O)/mo1 | n(CO2)/ mo1 | n(H2)/ mo1 |
| 0 | 1 | 4 | 0 | 0 |
| 4 | 0.25 | 3.25 | 0.75 | 0.75 |
| 6 | n1 | n2 | n3 | n4 |
| 8 | n1 | n2 | n3 | n4 |
| t | 0.15 | 3.15 | 0.85 | 0.85 |
A.前4 min,用CO表示的化学反应速率为v(CO)=0.25mol/(L·min)
B.反应在第4 min时处于化学平衡状态
C.8分钟时,混合气体中CO2的体积分数为16%
D.t分钟时,反应所处的温度高于850℃
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
N2(g)+3H2(g) ![]() 2NH3(g);ΔH<0
2NH3(g);ΔH<0

请根据图示回答下列问题:
(1)反应起始时,氮气与氢气的物质的量之比n(N2)∶n(H2)= _________∶_________。在15分钟时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为_________________________。
(2)在t1时,曲线发生变化的原因是__________________、__________________。请计算氢气在t1起点时的坐标(_________,_________)以及在t2平衡时的坐标(_________,_________)。并在图中画出在t1—t2之间氢气的物质的量变化曲线。
(3)为达到图示中t2的平衡状态,在t1—t2之间需要采取的措施是_________。
a.扩大容器的体积
b.升高温度
c.降低温度
d.缩小容器的体积
(4)经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比n(N2)∶n(H2)= _________∶_________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)= _________∶_________。
(5)根据以上计算结果,请你建议合成氨反应的最佳原料比是:n(N2)∶n(H2)=_________。
查看答案和解析>>
科目:高中化学 来源:2010年福建省厦门外国语学校高三模拟考试(理综)化学部分 题型:填空题
(15分)A、B、C、D、E、F是原子半径依次减小的短周期元素,A、C两元素形成的化合物是厨房中最常用的调味品,A、B、C的最高价氧化物对应的水化物两两间均能反应生成盐和水;D元素的同位素之一被用来作为相对原子质量和阿伏加德罗常数的标准;E元素能形成多种同素异 形体,其中一种是导致许多食品、药品变质的气体;F元素的氧化物是许多有机物燃烧的液态生成物。据此回答:
形体,其中一种是导致许多食品、药品变质的气体;F元素的氧化物是许多有机物燃烧的液态生成物。据此回答:
(1)A、C、E按原子个数之比1 :1 :1形成的化合物是一种常见的消毒剂,将该消毒剂的水溶液滴在pH试纸上,可观察到现象是 ,原因是 。
(2)我国首创的海洋电池以B的单质为负极,铂网为正极,空气做氧化剂,海水做电解质溶液。电池的正极反应式为  ,电池总反应的化学方程式为 。
,电池总反应的化学方程式为 。
(3)C的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式: ____________________________________。
(4)在1 L的密闭容器中,充入1 mo1DE和1 mo1 F2E (g),于850℃时进行化学反应:DE (g) + F2E (g) DE2(g) + F2(g) △H<0,达平衡时,有50%
DE2(g) + F2(g) △H<0,达平衡时,有50% 的DE转化为DE2。在相同温度下,将1 mo1DE和4 mo1 F2E (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
的DE转化为DE2。在相同温度下,将1 mo1DE和4 mo1 F2E (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
| 时间/min | n(DE)/ mo1 | n(F2E)/mo1 | n(DE2)/ mo1 | n(F2)/ mo1 |
| 0 | 1 | 4 | 0 | 0 |
| 4 | 0.25 | 3.25[来源:学。科。网Z。X。X。K] | 0.75 | 0.75 |
| 6 | n1 | n2 | n3 | n4 |
| 8 | n1 | n2 | n3 | n4 |
| t | 0.15 | 3.15 | 0.85 | 0.85 |
查看答案和解析>>
科目:高中化学 来源:2013届山西省康杰中学等四校高三第一次联考化学试卷(带解析) 题型:填空题
(共10分)甲醇合成反应及其能量变化如图所示:
(1)写出合成甲醇的热化学方程式________________________________。
实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年北京市朝阳区高三第一次综合练习(理综)化学部分 题型:选择题
已知:
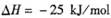 ,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加人CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加人CH3OH,反应到某时刻测得各组分的物质的量浓度如下:

下列说法正确的是
A. 平衡后升高温度,平衡常数>400
B. 平衡时,c(CH3OCH3)=1.6 mol/L
C. 平衡吋,反应混合物的总能量减少20kJ
D 平衡时,再加人与起始等量的CH3OH,达新平衡后CH3OH转化率增大
查看答案和解析>>
科目:高中化学 来源:2010年福建省高三模拟考试(理综)化学部分 题型:填空题
(15分)A、B、C、D、E、F是原子半径依次减小的短周期元素,A、C两元素形成的化合物是厨房中最常用的调味品,A、B、C的最高价氧化物对应的水化物两两间均能反应生成盐和水;D元素的同位素之一被用来作为相对原子质量和阿伏加德罗常数的标准;E元素能形成多种同素异形体,其中一种是导致许多食品、药品变质的气体;F元素的氧化物是许多有机物燃烧的液态生成物。据此回答:
(1)A、C、E按原子个数之比1 :1 :1形成的化合物是一种常见的消毒剂,将该消毒剂的水溶液滴在pH试纸上,可观察到现象是 ,原因是 。
(2)我国首创的海洋电池以B的单质为负极,铂网为正极,空气做氧化剂,海水做电解质溶液。电池的正极反应式为 ,电池总反应的化学方程式为 。
(3)C的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式: ____________________________________。
(4)在1 L的密闭容器中,充入1 mo1DE和1 mo1 F2E (g),于850℃时进行化学反应:DE (g) + F2E (g) DE2(g)
+ F2(g) △H<0,达平衡时,有50%的DE转化为DE2。在相同温度下,将1 mo1DE和4
mo1 F2E (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
DE2(g)
+ F2(g) △H<0,达平衡时,有50%的DE转化为DE2。在相同温度下,将1 mo1DE和4
mo1 F2E (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
|
时间/min |
n(DE)/ mo1 |
n(F2E)/mo1 |
n(DE2)/ mo1 |
n(F2)/ mo1 |
|
0 |
1 |
4 |
0 |
0 |
|
4 |
0.25 |
3.25[来源:学。科。网Z。X。X。K] |
0.75 |
0.75 |
|
6 |
n1 |
n2 |
n3 |
n4 |
|
8 |
n1 |
n2 |
n3 |
n4 |
|
t |
0.15 |
3.15 |
0.85 |
0.85 |
①反应在第4 min时,v(正) v(逆)(填“>”、“=”或“<”)。
②8分钟时,混合气体中DE2的体积分数为 。
③t分钟时,反应所处的温度 850℃(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com