
【题目】常温下,用0.01molL-1的NaOH溶液滴定20mL同浓度的HCN溶液,滴定曲线如图所示,下列说法正确的是( )

A. Ka(HCN)的数量级为10-8
B. 点①时,向溶液中滴入几滴1mol/L的HCN溶液,溶液中c(H+)/ c(HCN)的值增大
C. 点②时,溶液中微粒浓度大小关系:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)
D. 在标示的四种情况中,水的电离程度最大的是②
【答案】C
【解析】
A.根据图像可知,①时为HCN溶液,其c(H+)约为10-6mol/L,Ka(HCN)= c(H+)×c(CN-)/c(HCN)=10-6×10-6/0.01=10-10,数量级约为10-10;
B. 点①时,向溶液中滴入几滴1mol·L-1的HCN溶液为加水稀释的逆过程,加水稀释平衡向电离的方向移动,逆过程为生成分子的方向移动,c(H+)减小,c(HCN)增大,![]() 的值减小;
的值减小;
C. 点②时,溶液为NaCN与HCN混合液,且物质的量相等,此时溶液显碱性,水解程度大于电离程度,则c(HCN)>c(Na+)>c(CN-),由于水解是少量的水解,则c(CN-)>c(OH-);
D. 在标示的四种情况中,③刚好生成NaCN盐,水解程度最大;
A.根据图像可知,①时为HCN溶液,其c(H+)约为10-6mol/L,Ka(HCN)= c(H+)×c(CN-)/c(HCN)=10-6×10-6/0.01=10-10,数量级约为10-10,A错误;
B. 点①时,向溶液中滴入几滴1mol·L-1的HCN溶液为加水稀释的逆过程,加水稀释平衡向电离的方向移动,逆过程为生成分子的方向移动,c(H+)减小,c(HCN)增大,![]() 的值减小,B错误;
的值减小,B错误;
C. 点②时,溶液为NaCN与HCN混合液,且物质的量相等,此时溶液显碱性,水解程度大于电离程度,则c(HCN)>c(Na+)>c(CN-),由于水解是少量的水解,则c(CN-)>c(OH-),C正确;
D. 在标示的四种情况中,③刚好生成NaCN盐,水解程度最大,D错误;
答案为C


科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率有效的是( )
A.![]() 与稀硫酸反应制取H2时,改用浓硫酸
与稀硫酸反应制取H2时,改用浓硫酸
B.Na与水反应时,增大水的用量
C.在K2SO4溶液与BaCl2溶液反应时,增大压强
D.在密闭容器中进行反应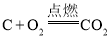 时,压缩容器体积,增大压强
时,压缩容器体积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中含有高浓度的![]() 、
、![]() ,在排放前必须进行脱硫、脱硝处理。回答下列问题:
,在排放前必须进行脱硫、脱硝处理。回答下列问题:
(1)利用![]() 可以将氮的氧化物还原为
可以将氮的氧化物还原为![]() 。
。
已知:![]()
![]()
![]()
![]()
则反应![]() 的
的![]() ________
________![]() 。
。
(2)在体积为1L的恒容密闭容器里,充入![]() 和
和![]() ,发生反应为:
,发生反应为:![]()
![]() ,得
,得![]() 随温度变化如图所示:
随温度变化如图所示:

①a点时,反应是否已达平衡状态________(填“是”或“否”)。
②该反应正反应的![]() ________(填“
________(填“![]() ”或“
”或“![]() ”)0。
”)0。
③当反应体系中![]() ,________(填“能”或“不能”)说明反应达平衡状态。
,________(填“能”或“不能”)说明反应达平衡状态。
④![]() ℃时该反应的平衡常数为________。
℃时该反应的平衡常数为________。
(3)工业上可以用![]() 溶液吸收
溶液吸收![]() ,并用电解法处理吸收后所得
,并用电解法处理吸收后所得![]() 溶液以实现吸收液的回收再利用(装置如图所示)。电源a端为________极,阳极的电极反应式为________。
溶液以实现吸收液的回收再利用(装置如图所示)。电源a端为________极,阳极的电极反应式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.A点溶液中加入少量水:![]() 增大
增大
B.B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C.C点:c(Na+) =c(HA-)+2c( A2-)
D.水电离出来的c(OH -):B点>D点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,有关微粒的物质的量浓度关系不正确的是![]()
![]()
A.![]() 溶液:
溶液:![]()
B.将![]() 溶液逐滴滴加到
溶液逐滴滴加到![]() 盐酸中:
盐酸中:![]()
C.![]() 溶液与等体积
溶液与等体积![]() 的醋酸混合后的溶液中:
的醋酸混合后的溶液中:![]()
D.![]() 溶液:
溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.lmol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取5mL0.1mol·L-1KI溶液,加入3mL0.1mol·L-1FeCl3溶液混合,分别取2mL此混合溶液于2支试管中进行如下实验:
①第一支试管中加入1 mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴KSCN溶液,溶液变红。
实验②说明:在![]() 过量的情况下,溶液中仍含有________(填离子符号)。
过量的情况下,溶液中仍含有________(填离子符号)。
(5)丁组同学向盛有少量H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜![]() 含杂质
含杂质![]() 与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
![]() 溶液B经过________、__________、___________可得到氯化铜晶体;
溶液B经过________、__________、___________可得到氯化铜晶体;
![]() 检验溶液B中是否存在
检验溶液B中是否存在![]() 的方法是_________;
的方法是_________;
![]() 下列物质适合于调节溶液的pH得溶液B的是________
下列物质适合于调节溶液的pH得溶液B的是________
A.NaOH溶液 ![]()
![]() 氨水
氨水 ![]()
![]() 已知元素在高价态时常表现氧化性,若在酸性
已知元素在高价态时常表现氧化性,若在酸性![]() 溶液中加入一定量的
溶液中加入一定量的![]() 和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验事实及其解释都正确的是( )
A.将饱和氯水滴到淀粉碘化钾试纸上出现如图所示的现象,说明低浓度氯水能将I-氧化成I2,高浓度氯水能将I2进一步氧化成碘的化合物
B.将过量CO2通入Ca(ClO)2溶液中得到澄清溶液,说明H2CO3的酸性比HClO的弱
C.用饱和Na2CO3溶液可将BaSO4转化为BaCO3,说明Ksp(BaSO4)>Ksp(BaCO3)
D.铝箔在酒精灯火焰上加热熔化,但不滴落,说明铝箔表面的氧化铝膜的熔点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com