
25℃时,弱酸的电离平衡常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
下列有关说法正确的是
A.等物质的量浓度的各溶液的pH关系为: pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol/L HCN与a mol/L NaOH溶液等体积混合后所得溶液呈中性
C.往冰醋酸中逐滴加水稀释,溶液导电能力始终保持减小
D.等浓度Na2CO3溶液的碱性比NaHCO3溶液的碱性强
科目:高中化学 来源:2015-2016学年山西省高二上期中考试化学试卷(解析版) 题型:选择题
25℃时体积为1L浓度为0.15mol·L-1的NaOH溶液充分吸收2.24LCO2(标准状况),温度恢复到25℃。下列有关上述反应后溶液的说法及关系正确的是
A.反应过程中CO2过量,溶液的pH<7
B.水的离子积常数Kw<10-14
C.2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)]
D.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南信阳高级中学高二开学考试化学试卷(解析版) 题型:填空题
原子序数之和为16的三种短周期元素的单质X、Y、
Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化。已知B分子组成中Z原子个数比C分子中少一个。请回答下列问题:

(1)元素X的原子结构示意图
(2)C与X在一定条件下生成化合物A的化学方程式
(3)常温下,C的水溶液能够使红色石蕊试纸变蓝,请用离子方程式表示变蓝的原因
(4)写出A与C反应生成Y和B的化学方程式
(5)加热条件下,C通过装有含X的黑色粉末的硬质玻璃管,黑色粉末变成紫红色,该黑色粉末的化学式 ;发生反应化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省贵阳市新天学校高一上学期期中测试化学试卷(解析版) 题型:选择题
下列各组物质按酸、碱、盐分类顺序排列正确的是
A.硫酸、纯碱、石膏 B.碳酸、乙醇、醋酸钠
C.氢硫酸、烧碱、胆矾 D.磷酸、熟石灰、苛性钾
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高二上学期期中测试化学试卷(解析版) 题型:填空题
(1)用注射器吸入少量NO2和N2O4的混合气体,发生如下反应:2NO2(g)?N2O4(g)当活塞迅速向里推时,气体的颜色先 ,后 (填“变深”“变浅”或“不变”前同);最终和最初相比,颜色 更深(填“最初”或“最终”下同),气体的平均相对分子质量 更大.
(2)在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L﹣1.请填空:
xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol•L﹣1.请填空:
①x= ,②B的转化率为 .
③温度降低,K值增大,则正反应是 (填“放热”或“吸热”)反应.
④能判断该反应达到平衡状态的依据是 (填编号)
A、混合气体的密度不变
B、容器中的压强不再变化
C、生成D的反应速率是生成B的反应速率的2倍
D、单位时间内生成3molA,同时生成1molB
⑤在其他条件不变的情况下,将原容器体积扩大到4L,下列有关该体系的说法正确的是( )(填编号)
A、B的浓度减少
B、正反应速率加快,逆反应速率也加快
C、C的物质的量增加
D、重新平衡时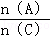 增大.
增大.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高一上学期期中测试化学试卷(解析版) 题型:选择题
下列实验中,所选装置不合理的是
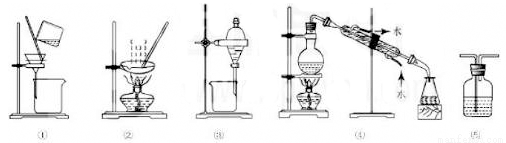
A.分离Na2CO3溶液和CCl4,选④ B.用CC14提取碘水中的碘,选③
C.用FeC12溶液吸收C12,选⑤ D.粗盐提纯,选①和②
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省许昌、襄城、长葛三校高一上期中测试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.酸碱中和反应均可表示为:OH-+H+=H2O
B.碳酸氢钠溶液与烧碱溶液混合:HCO3-+OH—=CO32-+H2O
C.硫酸和氢氧化钡溶液反应:H++SO42-+Ba2++OH—=BaSO4↓+H2O
D.铜片插入硝酸银溶液中:Cu+Ag+=Ag+Cu2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二上学期第一次月考化学试卷(解析版) 题型:选择题
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1
C.-330 kJ·mol-1 D.+330 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届广西省高三上学期期中测试化学试卷(解析版) 题型:填空题
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
回答下列问題:
(1)二价铜离子的电子排布式为 .已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释
(2)(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为_________.类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 .
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3.在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 .
(4)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 .六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3.(只要求列算式).
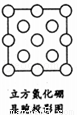
(5)如图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com