
【题目】120℃时,某含C、H、O三种元素的有机物4.6g在O2中完全燃烧,若将生成的气体全部通过浓硫酸,则浓硫酸质量增加5.4g;若将生成的气体全部通过足量的过氧化钠,过氧化钠的质量增加6.2g(假定气体全部吸收).
(1)试通过计算推断该有机物的分子式 。
(2)该有机物有多种同分异构体,其中一种核磁共振氢谱只出现一种峰,写出满足该条件的有机物的结构简式_______________。
【答案】
(1)C2H6O。
(2)CH3OCH3。
【解析】
试题分析:(1)浓硫酸质量增加5.4g为燃烧生成水的质量,
其物质的量=![]() =0.3mol,n(H)=0.3mol×2=0.6 mol,
=0.3mol,n(H)=0.3mol×2=0.6 mol,
2Na2O2+2H2O=4NaOH+O2 △(m)
36 32 4
5.4 g m(H)
m(H)=![]() =0.6 g
=0.6 g
2Na2O2+2CO2=2Na2CO3+O2 △(m)
88 32 56
m(CO2) 6.2 g-m(H)=6.2g-0.6g=5.6g
m(CO2)=![]() =8.8 g,n(C)=
=8.8 g,n(C)=![]() =0.2 mol,
=0.2 mol,
m(C)+m(H)=0.2mol×12g/mol+0.6mol×1g/mol=3g<4.6g,故有机物还含有O元素,则n(O)=![]() =0.1 mol,故该有机物分子中C、H、O原子数目之比=n(C):n(H):n(O)=0.2:0.6:0.1=2:6:1,有机物的最简式为C2H6O,H原子已经饱和C的四价结构,故有机物分子式为C2H6O,答:该有机物分子式为C2H6O;
=0.1 mol,故该有机物分子中C、H、O原子数目之比=n(C):n(H):n(O)=0.2:0.6:0.1=2:6:1,有机物的最简式为C2H6O,H原子已经饱和C的四价结构,故有机物分子式为C2H6O,答:该有机物分子式为C2H6O;
(2)该有机物分子式为C2H6O,能与Na反应生成氢气,则有机物含有羟基,其结构简式为CH3CH2OH,故答案为:CH3CH2OH。


科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅的叙述中,正确的是( )
A.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位
B.硅的化学性质不活泼,在常温下不与任何物质反应
C.硅在电子工业中是最重要的半导体材料
D.硅的性质很稳定,能以单质的形式存在于自然界中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水分子间存在氢键,所以水分子比较稳定
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是离子化合物
C. I2加热升华过程中只需克服分子间作用力
D. SiO2熔化破坏共价键和分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(![]() )在生产和生活领域应用广泛,其制备反应为:
)在生产和生活领域应用广泛,其制备反应为:![]()
![]() 。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
A. 实验室制备过碳酸钠时可釆用冷水浴控制反应温度
B. 过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂
C. 过碳酸钠应密封保存,放置于冷暗处
D. 过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在给定条件下能够大量共存的是
A. 通入足量SO2气体后的溶液中:H+、Ca2+、Fe3+、NO3-
B. 无色溶液中:Al3+、NH4+、Cl-、S2-
C. 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
D. c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2溶于水所得溶液的性质为( )
A.有氧化性,无还原性,无酸性
B.无氧化性,有还原性,无酸性
C.有氧化性,有还原性,有酸性
D.无氧化性,有还原性,有酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是 ①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
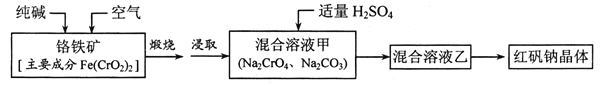
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________![]() 配平上述化学反应方程式。
配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有 关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com