
【题目】已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应呈黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃. 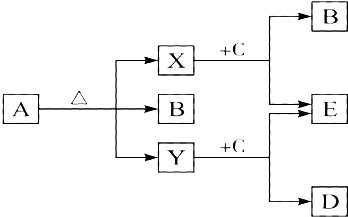
(1)写出下列物质的化学式:A , B , C , D , E .
(2)写出A受热分解的化学方程式: .
(3)写出Y与C反应的离子方程式 .
【答案】
(1)NaHCO3;Na2CO3;Na2O2;NaOH;O2
(2)2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(3)2Na2O2+2H2O=4NaOH+O2↑
【解析】解:E为气体单质,能使带火星的木条复燃,则E为O2 , 分别由X和Y与C反应生成,则C应为Na2O2 , X、Y为CO2和H2O中的物质, A加热分解生成X、Y、B,B应为Na2CO3 , 则D为NaOH,所以X为CO2 , Y为H2O, A加热生成Na2CO3、CO2、和H2O,则A为NaHCO3 , 加热分解的化学方程式为2NaHCO3 ![]() Na2CO3+CO2↑+H2O,过氧化钠与水反应生成氢氧化钠和氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑;所以答案是:(1)NaHCO3、Na2CO3、Na2O2、NaOH、O2;(2)2NaHCO3
Na2CO3+CO2↑+H2O,过氧化钠与水反应生成氢氧化钠和氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑;所以答案是:(1)NaHCO3、Na2CO3、Na2O2、NaOH、O2;(2)2NaHCO3 ![]() Na2CO3+CO2↑+H2O;(3)2Na2O2+2H2O=4NaOH+O2↑.
Na2CO3+CO2↑+H2O;(3)2Na2O2+2H2O=4NaOH+O2↑.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol?L﹣1 CH3COOH溶液中加入少量水,溶液中 ![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中 ![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中 ![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中 ![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大 , 原因是 .
(2)哪一段时段的反应速率最小 , 原因是
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率 .
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:你认为可行的是(填编号). A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A:
①由C,H,O三种元素组成,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%
②如图是该有机物的质谱图.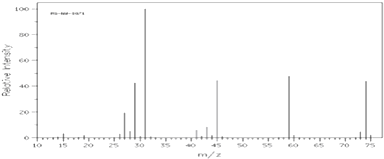
③A的红外光谱图上有C﹣H键、O﹣H键、C﹣O键的振动吸收峰.
④A的核磁共振氢谱有两个峰.请回答:
(1)A的实验式(最简式)为 , 相对分子质量为 .
(2)已知A的最简式能否确定A的分子式(填“能”或“不能”) , 理由是 .
(3)A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①﹣⑧在表中的位置,用化学用语回答下列问题:
族 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为 .
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 .
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用催化剂为(填序号) . a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)用电子式表示①、④两种元素形成18电子的形成过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是 .
A.SO32﹣和NO2﹣
B.NO3﹣和SO3
C.H3O+和ClO3﹣
D.PO43﹣和SO32﹣
(2)CaF2的晶胞如图所示. 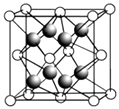
①下列有关CaF2的表达正确的是
a.Ca2+与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣ , 则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示,已知[AlF6]3﹣在溶液中可稳定存在).
③晶胞中F﹣的配位数是 , 与一个Ca2+等距离且最近的Ca2+有个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
电离能/kJmol﹣1 | I1 | I2 |
铜 | 746 | 1958 |
锌 | 906 | 1733 |
④写出Cu原子核外电子排布式;
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com