
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大 , 原因是 .
(2)哪一段时段的反应速率最小 , 原因是
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率 .
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:你认为可行的是(填编号). A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液.
【答案】
(1)2~3min;因反应为放热反应,温度升高,反应速率增大
(2)4~5min;4~5min时间段H+浓度小
(3)0.1mol/(L?min)
(4)A、B
【解析】解:(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、20mL,由此可知反应速率最大的时间段为2~3 min;故答案为:2~3 min;因反应为放热反应,温度升高,反应速率增大;(2)反应速率最小的时间段是4~5min时间段,此时温度虽然较高,但H+浓度小,故答案为:4~5 min;此时H+浓度小;(3)在2~3min时间段内,n(H2)= ![]() =0.005mol,根据2HCl~H2 , 计算消耗盐酸的物质的量为0.01mol,则υ(HCl)=
=0.005mol,根据2HCl~H2 , 计算消耗盐酸的物质的量为0.01mol,则υ(HCl)= ![]() =0.1 mol/(Lmin),故答案为:υ(HCl)=0.1 mol/(Lmin);(4)A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确; B.加入NaCl溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确; C.加入Na2CO3溶液,生成CO2气体,影响生成氢气的量,故C错误; D.加入CuSO4溶液,Zn置换出Cu反应速度增大,但影响生成氢气的量,故D错误;故答案为:AB. (1)和(2)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、20mL,生成气体体积越大的时间段,反应速率越大,结合温度、浓度对反应速率的影响分析;(3)计算出氢气的体积,根据2HCl~H2 , 计算消耗盐酸的物质的量,计算浓度的变化,根据v=
=0.1 mol/(Lmin),故答案为:υ(HCl)=0.1 mol/(Lmin);(4)A.加入蒸馏水,H+浓度减小,反应速率减小且不减少产生氢气的量,故A正确; B.加入NaCl溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确; C.加入Na2CO3溶液,生成CO2气体,影响生成氢气的量,故C错误; D.加入CuSO4溶液,Zn置换出Cu反应速度增大,但影响生成氢气的量,故D错误;故答案为:AB. (1)和(2)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、20mL,生成气体体积越大的时间段,反应速率越大,结合温度、浓度对反应速率的影响分析;(3)计算出氢气的体积,根据2HCl~H2 , 计算消耗盐酸的物质的量,计算浓度的变化,根据v= ![]() 计算反应速率;(4)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量;
计算反应速率;(4)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量;


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】[化学--选修2:化学与技术]高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等.以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
回答下列问题:
(1)原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 .
(2)“平炉”中发生的化学方程式为 .
(3)“平炉”中需要加压,其目的是 .
(4)将K2MnO4转化为KMnO4的生产有两种工艺.
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4 , MnO2和(写化学式).
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
, 阴极逸出的气体是 .
③“电解法”和“CO2歧化法”中,K2MnO4的理论利用率之比为 .
(5)高锰酸钾纯度的测定:称取1.0800g样品,溶解后定容于100mL容量瓶中,摇匀.取浓度为0.2000molL﹣1的H2C2O4标准溶液20.00mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48mL,该样品的纯度为(列出计算式即可,已知2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟含有SO2和NOx , 形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
(1)NaClO2的化学名称为 .
(2)在鼓泡反应器中通入含SO2、NOx的烟气,反应温度323K,NaClO2溶液浓度为5×10﹣3molL﹣1 . 反应一段时间后溶液中离子浓度的分析结果如表.
离子 | SO42﹣ | SO32﹣ | NO3﹣ | NO2﹣ | Cl﹣ |
c/(molL﹣1) | 8.35×10﹣4 | 6.87×10﹣6 | 1.5×10﹣4 | 1.2×10﹣5 | 3.4×10﹣3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式 . 增加压强,NO的转化率(填“提高”、“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐(填“增大”、“不变”或“减小”).
③由实验结果可知,脱硫反应速率脱硝反应速率(填“大于”或“小于”)原因是除了SO2和NO在烟气中初始浓度不同,还可能是 .
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压p0如图所示.
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均(填“增大”、“不变”或“减小”).
②反应ClO2﹣+2SO32﹣═2SO42﹣+Cl﹣的平衡常数K表达式为 .
(4)如果采用NaClO、Ca(ClO)2替代NaClO2 , 也能得到较好的烟气脱硫效果.
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是 .
②已知下列反应:
SO2(g)+2OH﹣(aq)═SO32﹣(aq)+H2O(l)△H1
ClO﹣(aq)+SO32﹣(aq)═SO42﹣(aq)+Cl﹣(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42﹣(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO﹣(aq)+2OH﹣(aq)═CaSO4(s)+H2O(l)+Cl﹣(aq)的△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的污染与其来源不对应的是
A | B | C | D | |
污染 | 白色污染 | PM2.5 | 氮氧化物 | 水体富营养化 |
来源 | 废弃塑料 | 化石燃料燃烧 | 汽车尾气 | 石油化工废弃物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.SiO2 ![]() SiCl4
SiCl4 ![]() Si
Si
B.FeS2 ![]() SO2
SO2 ![]() H2SO4
H2SO4
C.N2 ![]() NH3
NH3 ![]() NH4Cl(aq)
NH4Cl(aq)
D.MgCO3 ![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为NA
B.常温常压下,1.06gNa2CO3含有的Na+数为0.02NA
C.通常状况下,NA个CO2分子占有的体积为22.4L
D.标准状况下,22.4LH2O含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1mol X和1mol Y混合于2L的密闭容器中,发生如下反应 2X(g)+Y(g)=nZ(g)+2W(g),2min末X的物质的量为0.2mol,以Z的浓度表示的反应速率为0.1mol/(Lmin) 请回答:
(1)前2min以X的浓度表示的平均反应速率
(2)n值.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应呈黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃. 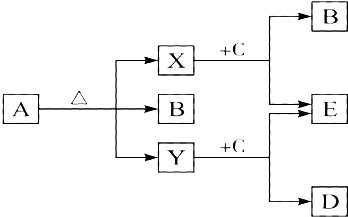
(1)写出下列物质的化学式:A , B , C , D , E .
(2)写出A受热分解的化学方程式: .
(3)写出Y与C反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化工生产的主要设备及尾气的主要成分完全正确的是
A.炼铁—电炉—CO、CO2、N2
B.氨气—氧化炉—N2、H2
C.炼钢—转炉—Fe2O3、CO
D.硫酸—合成塔—SO2、SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com