
【题目】Ⅰ 有机物具有广泛的用途。现有下列有机物:①乙烯 ②1,3-丁二烯 ③甲醛 ④油脂。请将相应的序号填入空格内。
(1)能用于制备肥皂的是_________;
(2)能用于制备聚乙烯塑料的是_________;
(3)能用于制备顺丁橡胶的是____________;
(4)能用于制备酚醛树脂的是____________。
Ⅱ.按要求回答下列问题:
(1) 名称为____________。
名称为____________。
(2)A,B,C三种烃的化学式均为C6H10,它们的分子中均无支链或侧链。
①若A为环状,则其结构简式为________。
②若B为含有双键的链状结构,且分子中不存在“![]() ”基团,则其可能的结构简式为__________(任写一种)。
”基团,则其可能的结构简式为__________(任写一种)。
③若C为含有三键的链状结构,则其可能的结构简式及名称为___________。
【答案】④ ① ② ③ 2,5-二甲基-4-乙基庚烷 ![]() CH2=CH-CH=CH-CH2-CH3(或CH2=CH-CH2-CH=CH- CH3、CH3-CH=CH-CH=CH-CH3等合理答案) CH≡C-CH2-CH2-CH2-CH3、1-己炔,CH3-C≡C-CH2-CH2-CH3、2-己炔,
CH2=CH-CH=CH-CH2-CH3(或CH2=CH-CH2-CH=CH- CH3、CH3-CH=CH-CH=CH-CH3等合理答案) CH≡C-CH2-CH2-CH2-CH3、1-己炔,CH3-C≡C-CH2-CH2-CH3、2-己炔,
CH3-CH2-C≡C-CH2-CH3、3-己炔等
【解析】
I.(1)油脂在碱性溶液中水解可制备肥皂;
(2)乙烯发生加聚反应可制备聚乙烯塑料;
(3)1,3-丁二烯发生加聚反应制备顺丁橡胶;
(4)苯酚与甲醛发生缩聚反应制备酚醛树脂;
II.(1)根据烷烃的系统命名方法命名;
(2)A、B、C三种烃的化学式均为C6H10,不饱和度为(6×2+2-10)÷2=2,可能是2个双键造成,也可能是一个环和一个碳碳双键造成,也可能是碳碳三键造成,然后根据题目要求写出相应的物质的结构简式。
(1)肥皂的主要成分为高级脂肪酸盐,则油脂在碱性溶液中水解可产生高级脂肪酸钠盐,用于制备肥皂,故合理选项是④;
(2)乙烯中含碳碳双键,在一定条件下可发生加聚反应产生聚乙烯,聚乙烯是制备聚乙烯塑料的主要原料,故合理选项是①;
(3)1,3-丁二烯中含二个碳碳双键,在一定条件下可发生加聚反应制备聚1,3-丁二烯,聚1,3-丁二烯即为顺丁橡胶,故合理选项是②;
(4) 苯酚与甲醛在一定条件下发生缩聚反应制备酚醛树脂和水,酚醛树脂为缩聚产物,故合理选项是③;
II.(1)选择含有碳原子数最多的碳链为主链,最长碳链上有7个C原子,从右端为起点,给主链上的C原子编号,以确定支链的位置,该烷烃名称为2,5-二甲基-4-乙基庚烷;
(2)①若A为环状,则A含有一个碳碳双键和一个环,则其可能的结构简式为![]() ;
;
②若B为含有双键的链状结构,且分子中不存在“![]() ”基团,则其可能的结构简式为CH2=CH-CH=CH-CH2-CH3、CH2=CH-CH2-CH=CH-CH3、CH3-CH=CH-CH=CH-CH3等;
”基团,则其可能的结构简式为CH2=CH-CH=CH-CH2-CH3、CH2=CH-CH2-CH=CH-CH3、CH3-CH=CH-CH=CH-CH3等;
③若C为含有三键的链状结构,则C为炔烃,其可能的结构简式CH≡C-CH2-CH2-CH2-CH3,名称为1-己炔;结构简式CH3-C≡C-CH2-CH2-CH3,名称为2-己炔;结构简式CH3-CH2-C≡C-CH2-CH3,名称为3-己炔等。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的2p电子数是2s电子数的一半,由Y、Z元素组成的某种化合物是一种常用的漂白剂、供氧剂,Z和R位于同周期且R的基态原子中有3个电子能量最高,M2+与过量氨水作用,先得到蓝色沉淀后转化为深蓝色溶液Q。请回答下列问题:
(1)Z、R、M三种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(2)XCl3、RCl3两种分子中属于非极性分子的是_______ (填化学式)。
(3)已知H2Y2和RH3的相对分子质量相同,H2Y2的熔点为-0.43℃,沸点为158℃,而RH3的熔点为-133℃,沸点为-87.7℃,其主要原因是_________。
(4)X、R元素可形成一种具有立体网状结构的化合物,其晶胞结构如图所示,该化合物的晶体类型是______,化学式为________,X的配位数是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案中均使用了NaCl溶液,能达到实验目的的是( )
编号 | A | B | C | D |
实验 方案 |
置于光亮处 |
|
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
|
实验 目的 | 验证甲烷与氯气发生化学反应 | 进行喷泉实验 | 验证Fe电极被保护 | 验证乙炔的还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
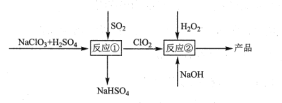
下列说法错误的是( )
A. 反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B. 若反应①通过原电池来实现,则ClO2是正极产物
C. 反应②中的H2O2可用NaClO2代替
D. 反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操 作 | 现 象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是 ,形成白雾的原因是 。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有 。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
① 实验b检出的气体使之变蓝,反应的离子方程式是________________。实验证实推测成立。
② 溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是 。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ 。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是 。
②方案2中检验Fe2+ 的原因是 。
③综合方案1、2的现象,说明选择NaBr溶液的依据是 。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某校研究小组尝试回收废旧正极材料中的钴。
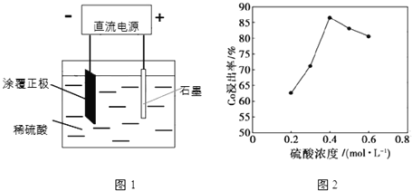
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O,阳极的电极反应式为______。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4molL-1时,钴的浸出率下降,其原因可能为______。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式______。该步骤一般在80℃以下进行,温度不能太高的原因是______。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是______(填字母序号)。
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项实验基本操作中,正确的是
A. 为了加快锌和稀硫酸反应的速率,可以向稀硫酸中加入少量硫酸铜![]()
B. 在做中和滴定实验时清洗滴定管后,直接装液滴定
C. 为了加快过滤速度,用玻璃棒搅拌过滤器中的液体
D. 为了使配制的氯化铁溶液保持澄清,加入盐酸和铁片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】头孢拉定又名先锋霉素,是常用的一种抗生素,其结构简式如图:
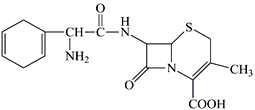
下列说法不正确的是( )
A. 头孢拉定的分子式是C16H19N3O4S,分子中有多种官能团
B. 头孢拉定与Na2CO3溶液、NaHCO3溶液都可以反应
C. 1mol头孢拉定最多可与6molH2和5mol Br2发生加成反应
D. 头孢拉定既可与盐酸反应,也可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为室温时不同pH下磷酸盐溶液中含磷微粒形态的分布,其中a、b、c三点对应的pH分别为2.12、7.21、11.31,其中δ表示含磷微粒的物质的量分数,下列说法正确的是
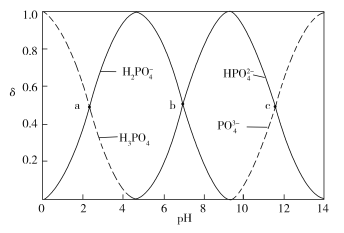
A.2 mol H3PO4与3 mol NaOH反应后的溶液呈中性
B.NaOH溶液滴定Na2HPO4溶液时,无法用酚酞指示终点
C.H3PO4的二级电离常数的数量级为107
D.溶液中除OH离子外,其他阴离子浓度相等时,溶液可能显酸性、中性或碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com