
【题目】X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的2p电子数是2s电子数的一半,由Y、Z元素组成的某种化合物是一种常用的漂白剂、供氧剂,Z和R位于同周期且R的基态原子中有3个电子能量最高,M2+与过量氨水作用,先得到蓝色沉淀后转化为深蓝色溶液Q。请回答下列问题:
(1)Z、R、M三种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(2)XCl3、RCl3两种分子中属于非极性分子的是_______ (填化学式)。
(3)已知H2Y2和RH3的相对分子质量相同,H2Y2的熔点为-0.43℃,沸点为158℃,而RH3的熔点为-133℃,沸点为-87.7℃,其主要原因是_________。
(4)X、R元素可形成一种具有立体网状结构的化合物,其晶胞结构如图所示,该化合物的晶体类型是______,化学式为________,X的配位数是________。

【答案】P>Cu>Na BCl3 两种物质均是分子晶体,H2O2分子间存在氢键而PCl3分子间不存在氢键 原子晶体 BP 4
【解析】
X、Y、Z、R、M五种元素的原子序数依次增大,基态X原子的2p电子数是2s电子数的一半,原子核外电子排布为1s22s22p1,则X为B元素;由Y、Z元素组成的一种化合物是一种常用的漂白剂、供氧剂,则Y为O元素、Z为Na;Z和R位于同周期且R的基态原子中有3个电子能量最高,外围电子排布使为3s23p3,故R为P元素;M2+与过量氨水作用先得到蓝色沉淀后转化为深蓝色溶液Q,则M为Cu。
(1)元素的非金属性越强,第一电离能越大,金属性越强,第一电离能越小;
(2)化合物BCl3的B原子孤电子对数为0,杂化轨道数目为3,为平面正三角形,而PCl3中P原子由1对孤对电子,价层电子对数为4,为三角锥形;
(3)H2O2分子之间形成氢键,熔沸点较高;
(4) 具有立体网状结构的化合物的晶体类型为原子晶体;根据均摊法计算晶胞中原子数目,确定化学式;R原子配位数为4,晶体中原子配位数与原子数目呈反比。
根据上述分析可知:X为B元素;Y为O元素、Z为Na元素;R为P元素;M为Cu元素。
(1)Z、R、M三种元素分别是Na、P、Cu,由于元素的非金属性越强,其第一电离能越大,元素的金属性越强,第一电离能越小,所以第一电离能由大到小的顺序为:P>Cu>Na,
(2)化合物BCl3的B原子孤电子对数为0,杂化轨道数目为3,B原子采取sp2杂化,为平面正三角形,分子中正负电荷重心重合,属于非金属性分子;而PCl3中P原子有1对孤对电子,价层电子对数为4,为三角锥形,分子中正负电荷重心不重合,属于极性分子;
(3)H2O2分子之间除存在分子间作用力外,还存在氢键;而PH3分子之间只存在分子间作用力,不能形成氢键,故H2O2熔沸点较高;
(4)X、R元素分别是B、P,二者可形成一种具有立体网状结构的化合物,则该晶体为原子晶体,由其晶胞结构可知,在该晶胞中含有的B原子数为8×![]() =4,晶胞中P原子数目为4,所以该化合物的化学式为BP,R原子配位数为4,晶体中R、X原子数目之比为1:1,故二者配位数相等,则X的配位数是4。
=4,晶胞中P原子数目为4,所以该化合物的化学式为BP,R原子配位数为4,晶体中R、X原子数目之比为1:1,故二者配位数相等,则X的配位数是4。


科目:高中化学 来源: 题型:
【题目】某相对分子质量小于200的芳香族含氧衍生物中氧的质量分数约为13.1%(仅含碳、氢、氧三种元素),已知其分子中含有2个-CH3,且该物质遇FeCl3溶液显紫色,则该有机物的结构式共有
A. 2种B. 4种C. 6种D. 8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为( )
A.-488.3kJ·mol-1
B.-191kJ·mol-1
C.-476.8kJ·mol-1
D.-1549.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下均能通过一步反应实现的是
A. NaAlO2(aq)![]() AlCl3
AlCl3![]() Al2O3
Al2O3
B. N2![]() NO2
NO2![]() HNO3
HNO3
C. NaCl(饱和)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
D. FeS2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础](15分)聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下:
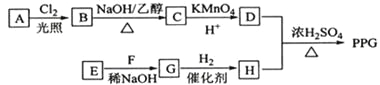
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④![]() 。
。
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)①由D和H生成PPG的化学方程式为 。
②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号)。
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 (写结构简式):
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明碳酸的酸性比硅酸强的事实是
A. 二氧化碳溶于水且能反应生成碳酸,二氧化硅不溶于水不能与水反应生成硅酸
B. 在高温下,二氧化硅与碳酸钠能发生反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
C. 二氧化硅的熔点比二氧化碳的熔点高
D. 二氧化碳通入硅酸钠溶液中,生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组根据反应 H2O2+2HI=2H2O+I2 探究影响化学反应速率的因素。实验数据如下
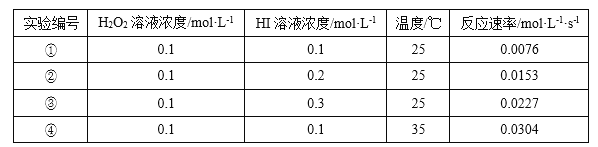
回答下列问题:
(1)反应 H2O2+2HI=2H2O+I2 中,氧化剂是_____。
(2)25℃时,表明增大反应物浓度,化学反应速率_____(填“增大”成“减小”)。
(3)能表明温度对化学反应速率影响的实验编号是①和_____。
(4)H2O2 不稳定,写出 H2O2 发生分解反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ B. KCl+AgNO3=AgCl↓+KNO3
C. 4NH3+5O2![]() 4NO+6H2O D. CaCO3
4NO+6H2O D. CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ 有机物具有广泛的用途。现有下列有机物:①乙烯 ②1,3-丁二烯 ③甲醛 ④油脂。请将相应的序号填入空格内。
(1)能用于制备肥皂的是_________;
(2)能用于制备聚乙烯塑料的是_________;
(3)能用于制备顺丁橡胶的是____________;
(4)能用于制备酚醛树脂的是____________。
Ⅱ.按要求回答下列问题:
(1) 名称为____________。
名称为____________。
(2)A,B,C三种烃的化学式均为C6H10,它们的分子中均无支链或侧链。
①若A为环状,则其结构简式为________。
②若B为含有双键的链状结构,且分子中不存在“![]() ”基团,则其可能的结构简式为__________(任写一种)。
”基团,则其可能的结构简式为__________(任写一种)。
③若C为含有三键的链状结构,则其可能的结构简式及名称为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com