
| | 已知 | 类推 |
| A | 向次氯酸钙溶液中通CO2气体: Ca2++2ClO-+CO2+H2O =CaCO3↓+2HClO | 向次氯酸钙溶液中通SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HclO |
| B | 用惰性电极电解硫酸 铜溶液:2Cu2++2H2O 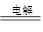 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ | 用铜电极电解硫酸铜溶液: 2Cu2++2H2O 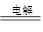 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| C | 稀硫酸与Ba(OH)2溶 液反应,pH=7时, 2H++SO42—+Ba2++2OH- =BaSO4↓+2H2O | 硫酸氢钠溶液与Ba(OH)2溶液反应, pH=7时,2H++SO42—+Ba2++2OH- =BaSO4↓+2H2O |
| D | Ba(OH)2溶液逐滴滴入硫酸铝钾 溶液至沉淀质量达到最大值: 2Ba2++4OH-+Al3++2SO42— =2BaSO4↓+AlO2—+2H2O | Ba(OH)2溶液逐滴滴入硫酸铝铵溶液至沉淀 质量达到最大值: 2Ba2++4OH-+Al3++2SO42—=2BaSO4↓+ AlO2—+2H2O |
科目:高中化学 来源:不详 题型:单选题
| A.Al3+、NO3-、K+、SO42- | B.Ca2+、Na+、CO32-、AlO2- |
| C.OH-、SO42-、NH4+、Al3+ | D.Fe3+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
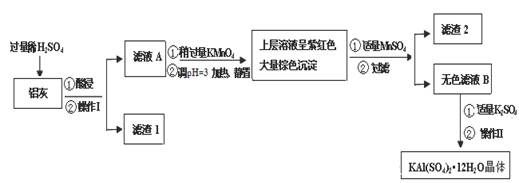
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 化学反应及离子方程式 | 评价 |
| A | NaClO溶液中通入少量的SO2:ClO-+H2O+SO2===Cl-+SO42-+2H+ | 错误,碱性介质中不可能生成H+ |
| B | 用酸性高锰酸钾溶液滴定草酸:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O | 正确 |
| C | NH4Al(SO4)2溶液中滴入几滴NaOH溶液:NH4++OH-===NH3·H2O | 错误,OH-首先和Al3+反应生成Al(OH)3沉淀 |
| D | 用惰性电极电解MgCl2溶液:2Mg2++2H2O 2Mg+O2↑+4H+ 2Mg+O2↑+4H+ | 正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
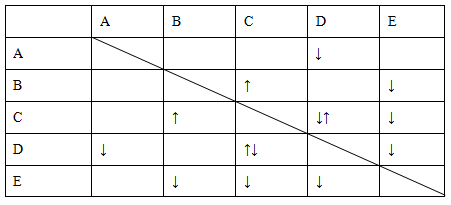
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+、Cu2+、Br一、Cl- | B.AlO2-、K+、NH4+、Na+ |
| C.K+、Na+、NO3-、H+ | D.K+、S2-、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向氢氧化钠溶液中通入少量的二氧化碳:CO2+OH-=HCO3- |
| B.单质硅与氢氟酸反应:Si+4HF=2H2↑+SiF4↑ |
| C.石英砂与烧碱反应生成水玻璃:SiO2+2OH-=SiO32-+H2O |
| D.向水玻璃中通入少量二氧化碳:SiO32-+2H2O+CO2=H4SiO4↓+CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50 mg/kg |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com