
【题目】下列指定反应的离子方程式正确的是
A. 用铁电极包解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 用强碱溶液吸收工业制取硝酸的尾气:NO+NO2+2OH-=2NO3-+H2O
C. 向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:Cu2++HS-=CuS↓+H+
D. 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O=[Al(OH)4]-+4NH4+
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
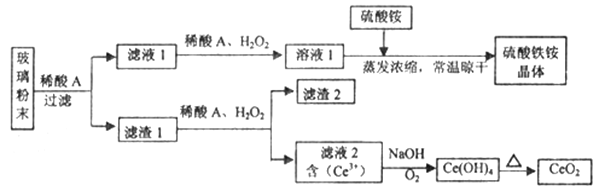
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)滤液1中加入H2O2溶液的目的是____________________________________________________。
(2)设计实验证明滤液1中含有Fe2+__________________________________________________________。
(3)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________________________________________________________________。
(4)由滤液2生成Ce(OH)4的离子方程式______________________________________________。
(5)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000 mol·L-1的FeSO4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为______________ (结果保留两位有效数字),Mr(Ce)=140。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)中和热测定的实验中,用到的玻璃仪器有烧杯、量筒、________、________。
(2)量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还需加入的试剂是________(填序号)。
A.50 mL 0.50 mol·L-1 NaOH溶液
B.50 mL 0.55 mol·L-1 NaOH溶液
C.1.0 g NaOH固体
(3)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如下表所示。
反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/ kJ·mol-1 |
A.1.0 mol/L HCl溶液50 mL、1.1 mol/L NaOH溶液50 mL | 13.0 | ΔH1 | |
B.1.0 mol/L HCl溶液50 mL、1.1 mol/L NH3·H2O溶液50 mL | 13.0 | ΔH2 |
①甲在实验之前预计ΔH1=ΔH2。他的根据是__________________________________;乙在实验之前预计ΔH1≠ΔH2,他的根据是__________________________________。
②实验测得的温度是:A的起始温度为13.0 ℃、终了温度为19.8 ℃;B的起始温度为13.0 ℃、终了温度为19.3 ℃。设充分反应后溶液的比热容c=4.184 J/(g·℃),忽略实验仪器的比热容及溶液体积的变化,则ΔH1=________;ΔH2=________。(已知溶液密度均为1 g/cm3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的5种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;B原子的最外层电子数是次外层电子数的两倍; C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
(1)B在元素周期表中的位置是_____________________;
(2)E的离子结构示意图是_____;DA中含有_______;(填化学键类型)
(3)BC2的电子式为________;(用具体元素表示,下同)
(4)C、D、E三种元素简单离子的离子半径由大到小的顺序是______________________;
(5)C和E形成氢化物的稳定性关系是__________________;为证明E最高价氧化物对应水化物酸性强于B时发生的化学反应方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氨氧化获得的高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3,工艺流程如下:
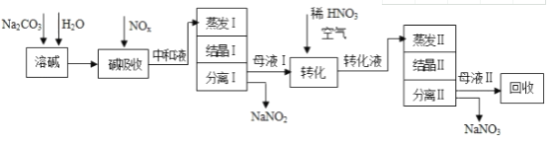
已知:Na2CO3+NO+NO2═2NaNO2+CO2
(1)中和液所含溶质除NaNO2及少量Na2CO3外,还有_________________(填化学式)。
(2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是_____________;蒸发Ⅰ产生的蒸汽中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的_____________________(填操作名称)最合理。
(3)母液Ⅰ进行转化时加入稀HNO3的目的是______________________________;母液Ⅱ需回收利用,下列处理方法合理的是_______。
a.转入中和液 b.转入结晶Ⅰ操作 c.转入转化液 d.转入结晶Ⅱ操作
(4)若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产1.38吨NaNO2时,Na2CO3的理论用量为______________吨(假定Na2CO3恰好完全反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条作下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H<0。查阅资料知SO3的熔点为16.83℃,沸点是448℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。
2SO3(g) △H<0。查阅资料知SO3的熔点为16.83℃,沸点是448℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。
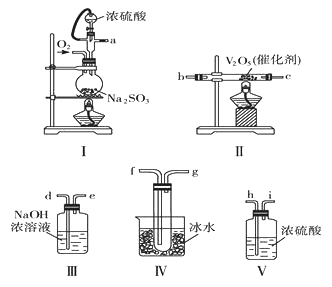
请根据要求回答问题:
(1)各装置接口的连接顺序是a→_________________。
(2)装置Ⅳ烧杯中盛放冰水的作用是_____________________。
(3)装置Ⅰ所用硫酸,一般选用浓度为70%~80%的硫酸,原因是_________________。
(4)当装置Ⅰ中反应结束时,要打开止水夹继续通入O2一段时间,继续通入O2的目的是_______。
(5)称量agNa2SO3粉末与足量硫酸反应,实验结束后称得装置Ⅳ增重bg,列式表示该实验中SO2的转化率__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素A、B、C、D、E、F,原子序数依次增大,A是周期表中原子半径最小的元素,B的基态原子中只有1个未成对电子,C基态原子中有7种不同运动状态的电子,D的最外层电子数是其所处周期数的3倍,E与D同主族,F的一价阳离子最外层有18个电子。回答下列问题:
(1)F在周期表中的位置是_____________,它的基态原子的电子排布式为_____________
(2)A元素与其他元素形成的含氧酸中,酸根呈三角锥结构的酸是_________,该酸的中心原子的杂化方式为_________
(3)CA3极易溶于水,试从下图中判断CA3溶于水后形成CA3·H2O的合理结构为_____(填字母代号),推理依据是___________

(4)元素B可形成H3BO3,已知H3BO3的电离方程式为H3BO3+2 H2O![]() [B(OH)4]一+H3O+
[B(OH)4]一+H3O+
①基态B、D原子的第一电离能由小到大的顺序为__________(用元素符号表示)
②[B(OH)4]一中B原子的杂化类型为_______________
③写出一种与H3O+互为等电子体的分子的化学式:___________
④H3BO3晶体在热水中的溶解度大于冷水中的溶解度的原因为__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com