
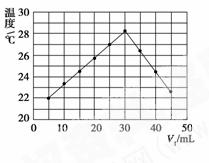
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
A.做该实验时环境温度为22 ℃
B.该实验表明所有化学反应化学能只转化为热能
C.NaOH溶液的浓度为1.50 mol·L-1
D.该实验表明有水生成的反应都是放热反应
科目:高中化学 来源: 题型:
如下表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 乙酸乙酯(乙酸) | KOH溶液,水 | 分液 |
| D | CO3(SO2) | Na2CO3 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(一) A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下图(图中部分产物未列出):
请填写下列空白:
(1)G是 。(用化学式填写)
(2)E与F反应的化学反应方程式是 。
(3)F与G的水溶液的反应生成I和D的离子方程式是 。
 (4)将2.5 g H、I和碳酸氢钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸
(4)将2.5 g H、I和碳酸氢钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸 的体积与产生CO2的体积(标准状况)关系如下图所示:
的体积与产生CO2的体积(标准状况)关系如下图所示:
则物质I的物质的量为_______________mol。
(二)工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯
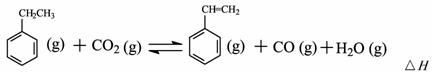 = -166KJ/mol
= -166KJ/mol
(1)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol/L和3.0mol/L,其中实验Ⅰ在T1℃,0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图Ⅰ所示。
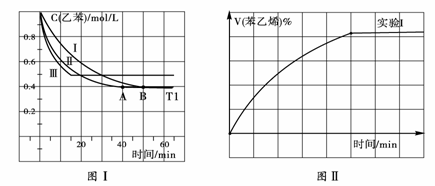
① 实验I乙苯在0—50min时的反应速率为
② 实验Ⅱ可能改变条件的是
③图II是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体
积分数V%随时间t的变化曲线。
(2)若实验Ⅰ中将乙苯的起始浓度改为1.2 mol/L,其他条件不变,乙苯的转化率将 (填“增大”、“减小”或“不变”),计算此时平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
使1mol乙烯与氯气发生加成反应,然后使该加成反应的产物与氯气在光照的条件
下进行取代(假设各步均完全反应),则两个过程中消耗的氯气的总物质的量是( )
A.6mol B.5mol C.4mol D.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃、101 kPa条件下:
4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2 834. 9 kJ·mol-1
4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3 119.1 kJ·mol-1 由此得出的正确结论是( )
①等质量的O2比O3能量低; ②等质量的O2比O3能量高;
③等质量的O3比O2稳定; ④等质量的O2比O3稳定;
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个
“封管实验”(夹持装置未画出),判断下列说法正确的是( )
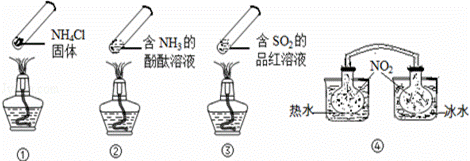
A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B.加热时,②、③溶液均变红,冷却后又都变为无色
C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内
气体颜色变浅
D.四个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对实验现象的描述中错误的是
A.向FeCl3和KSCN混合溶液中加入少量KCl固体,溶液血红色变浅
B.向5mL0.1mol/LK2Cr2O7溶液中加入少量NaOH固体,溶液由橙色变为黄色
C.等体积等浓度Na2S2O3和H2SO4混合,温度升高出现浑浊和生成气体速度加快
D.酸性KMnO4溶液中滴加H2C2O4,H2C2O4浓度越大褪色和生成气体速度越快
查看答案和解析>>
科目:高中化学 来源: 题型:
某500mL溶液中含0.1 mol Fe2+.0.2molFe3+,加入0.2mol铁粉,待Fe3+ 完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变) ( )
(提示:2 Fe3+ + Fe =3 Fe2+ )
A.0.4 mol/L B.0.6 mol/L C.0.8 mol/L D. l.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
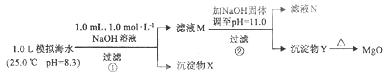
|
| Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0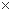 10-5mol
10-5mol L,可认为该离子不存在:
L,可认为该离子不存在:
实验过程中,假设溶液体积不变
Kkp,CaCo3=4.96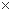 10-9 Kkp,MgCO3=6.82
10-9 Kkp,MgCO3=6.82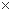 10-6
10-6
Kkp,Ca(OH)2=4.68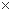 10-9 Kkp,Mg(OH)2=5.61
10-9 Kkp,Mg(OH)2=5.61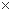 10-12
10-12
下列说法正确的是
A.沉淀物x为CaCO3
B.滤液M中存在Mg2+ ,不存在Ca2+
C.滤液N中存在Mg2+ , Ca2+
D.步骤②中应改为加入4.2g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com