
某500mL溶液中含0.1 mol Fe2+.0.2molFe3+,加入0.2mol铁粉,待Fe3+ 完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变) ( )
(提示:2 Fe3+ + Fe =3 Fe2+ )
A.0.4 mol/L B.0.6 mol/L C.0.8 mol/L D. l.0 mol/L
科目:高中化学 来源: 题型:
第三周期元素A、B、C,其原子序数依次增大,已知A的焰色为黄色,C的某种氧化物是形成酸雨的主要原因,且这三种元素的最高价氧化物的水化物有一种具有两性,且他们两两之间都能反应生成盐和水。
(1)填出元素符号A __________B __________C__________
(2) C 2- 离子结构示意图为
(3)A和C形成的化合物的电子式为 ,属于 化合物。
查看答案和解析>>
科目:高中化学 来源: 题型:
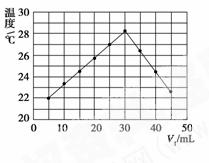
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
A.做该实验时环境温度为22 ℃
B.该实验表明所有化学反应化学能只转化为热能
C.NaOH溶液的浓度为1.50 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备H2的一种重要方法是:
CO(g) + H2O(g)  CO2 (g) + H2(g) △H=Q kJ/mol
CO2 (g) + H2(g) △H=Q kJ/mol
已知
该反应的平衡常数K与温度T的关系右上图所示。若在一固定的密闭容器中,
850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化
关系如下表:

已知:850℃ 时该反应的化学平衡常数K = 1.0 ,请回答下列问题:
(1) Q 0(填“ > ”、“ = ”或“<” )。
(2)若在850℃时向反应容器中充人H2O(g),K 值 (填增大、减小、不变)
(3)上表中 c2为 mol/L , CO(g)的转化率为 (保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
用10mL的0.1 mol·L-1BaCl2溶液恰好使同体积的硫酸铁.硫酸锌和硫酸钾三种溶液中的SO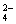 完全沉淀,则这三种溶液的物质的量浓度之比为( )
完全沉淀,则这三种溶液的物质的量浓度之比为( )
A.3:2:2 B.1:2:3 C.1:3:3 D.3:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示为常见仪器的部分结构。
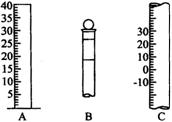
(1)请写出下列仪器的名称:A________,B________,C________。
(2)仪器B上标记有________(填序号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
(3)检验仪器B是否漏水的方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
要除掉粗盐中含有的氯化镁、硫酸镁等杂质。现设计一个除杂质的方案:把盐溶液溶于水,过滤成澄清溶液,再进行下列各步骤的处理:①加入氯化钡溶液至沉淀完全;②用盐酸调节pH至溶液呈微酸性;③加入NaOH溶液至沉淀完全;④过滤废弃滤出的沉淀;⑤加入碳酸钠溶液至沉淀完全;⑥蒸发浓缩使NaCl晶体析出。对上述各处理步骤的顺序安排合理的是( )
A.①②③④⑤⑥ B.③①⑤④②⑥ C.②①③④⑤⑥ D.②③⑤④①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式表达正确的是
A.向氯化铁溶液中滴加HI溶液:2Fe3++2HI==2Fe2++2H++I2
B.向NH4Al(SO4)2溶液中滴入Ba(0H)2恰好使反应完全:2Ba2++4OH-+Al3++2SO42-==2BaSO4+AlO2-+2H2O
C.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合2AlO2-+5H+==Al(OH)3+Al3++H2O
D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2==I2+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com