
【题目】某学生为了探究钠与CO2的反应,利用如图装置进行实验。(已知PdCl2能被CO还原得到黑色的Pd)

(1)请将上图各装置连接完整(填写装置中字母):c接f, _____接_____,_____接 _____, _____接_____ 。
(2)若用稀盐酸与CaCO3反应制备CO2,在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是( )
A.H2SO4溶液 | B.CCl4 | C.苯 | D.稀硝酸 |
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到_______________________ 时再点燃酒精灯。
(4)假如反应过程中有下列两种情况,分别写出两种情况下钠与CO2反应的化学方程式。
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体:__________________________
Ⅱ.装置①中钠的质量为0.46g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,且溶液中还有固体残留:_________________________。
【答案】(1)g 接 d ,e 接 a(或b) , b(或a) 接 h
(2)BD(错选不给分)
(3)装置⑤中澄清石灰水开始变浑浊
(4)Ⅰ.![]()
Ⅱ.![]()
【解析】试题分析:(1)根据实验目的,要探究钠与二氧化碳反应,制取的二氧化碳先通过饱和碳酸氢钠溶液除去HCl,再通过浓硫酸除去水蒸气,如何与钠反应,之后除去未反应的二氧化碳(用澄清石灰水)后通入氯化钯溶液中验证有一氧化碳生成。上图各装置连接完整(填写装置中字母):c接f,g 接d , e 接a(或b) , b(或a) 接h。
(2)H2SO4溶液与碳酸钙生成的硫酸钙微溶于水,使碳酸钙与酸溶液隔离停止反应,不能用硫酸;四氯化碳不溶于水且密度比水大,位于底部,盐酸液面上升就可以与碳酸钙接触,B可以;苯密度比水小,在上层,无法使盐酸与碳酸钙接触,C不可以;稀硝酸与碳酸钙生成二氧化碳,D可以。
(3)钠极易与水、氧气反应,为了防止它们干扰实验,用二氧化碳先将空气赶出;装置⑤中澄清石灰水变浑浊,说明装置内已充满二氧化碳。
(4)Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,说明反应有一氧化碳生成,钠被氧化为氧化钠,再与二氧化碳反应生成碳酸钠,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体,固体是碳酸钠,反应方程式为:2Na+2CO2 ![]() Na2CO3+CO
Na2CO3+CO
Ⅱ.装置①中钠的质量为0.46 g(0.02mol),充分反应后转移电子0.02mol,将装置①中的固体加入到足量稀盐酸中产生224 mL(0.01mol)CO2气体,生成的碳酸钠与反应的钠物质的量之比为1:2,溶液中还有固体残留,是生成的碳单质,根据得失电子守恒,化学方程式为:4Na+3CO2 ![]() 2Na2CO3+C。
2Na2CO3+C。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】在已达到电离平衡的1 mol·L-1的醋酸溶液中,欲使醋酸电离程度增大,同时使溶液的pH 增大,应采取的措施是( )
A. 通入少量HCl气体 B. 加热
C. 加少量醋酸钠晶体 D. 加少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231 ℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33 ℃、沸点为114 ℃。请按要求回答下列相关问题:
(1)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①步骤Ⅰ加入Sn粉的作用:__________________及调节溶液pH。
②步骤Ⅱ用到的玻璃仪器有烧杯、________________________。
③步骤Ⅲ生成SnO的离子方程式:__________________________。
④步骤Ⅳ中检验SnO是否洗涤干净的操作是:______________________,证明已洗净。
⑤步骤Ⅴ操作依次为____________、____________、过滤、洗涤、低温干燥。
(2)某化学兴趣小组对用于微电子器件生产的锡粉进行了纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3;③用0.1 000 mol/L K2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
①写出步骤②加入Fe2(SO4)3发生反应的离子方程式:____________________;
②此锡粉样品中锡的质量分数为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
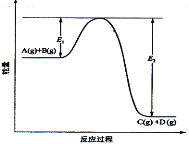
(1)该反应是__________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),原因是__________________;
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,在其他条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,在其他条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
A.保持体积不变,充入H2O(g)使体系压强增大
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于放热反应的是
A.灼热的碳与二氧化碳的反应 B.盐酸与烧碱溶液的反应。
C.乙醇在空气中的燃烧 D.氢氧化钡晶体与氯化铵晶体在常温下的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.25℃、101 kPa时,0.1NA个H2分子完全燃烧生成气态水,放出a kJ热量,表示氢气燃烧热的热化学方程式为H2(g)+![]() O2(g)= H2O(g) ΔH=-10a kJ·mol-1
O2(g)= H2O(g) ΔH=-10a kJ·mol-1
B.500℃、30 MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1。将分子数为1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3 kJ
2NH3(g) ΔH=-38.6kJ·mol-1。将分子数为1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3 kJ
C.在反应KClO3 +6HCl = KCl+3Cl2↑+3H2O中,每生成3 mol Cl2转移的电子数为5NA
D.以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极生成的H2在标准状况下体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是

A.反应的化学方程式为:2 M![]() N
N
B.t1时,N的浓度是M浓度的2倍
C.t2时,正逆反应速率相等,达到平衡
D.t3时,正反应速率大于逆反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com