
【题目】铁、钴、镍等过渡元素在工业生产和科学研究中具有重要作用,回答下列问题。
(1)![]() 简化的电子排布式为____________,第四电离能
简化的电子排布式为____________,第四电离能![]() ___
___![]() (填”>”或”<”)。
(填”>”或”<”)。
(2)![]() 常作净水剂和补铁剂,
常作净水剂和补铁剂,![]() 的空间构型为________,其中硫原子采用______杂化,任意写出一种
的空间构型为________,其中硫原子采用______杂化,任意写出一种![]() 的等电子体_______。
的等电子体_______。
(3)![]() 常温下呈液态;熔点为
常温下呈液态;熔点为![]() ,沸点为
,沸点为![]() ,易溶于非极性溶剂,据此可判断
,易溶于非极性溶剂,据此可判断![]() 晶体属于______(填晶体类型),若配合物
晶体属于______(填晶体类型),若配合物![]() 的中心原子价电子数与配体提供电子数之和为18,则
的中心原子价电子数与配体提供电子数之和为18,则![]() _________。
_________。
(4)氮化铁晶体的晶胞如图所示,该氮化铁晶体的化学式为______。

(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ![]() ,
,![]() 代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的
代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的![]() 数目为________,
数目为________,![]() 与
与![]() 最短核间距为_________pm。
最短核间距为_________pm。
【答案】![]() < 正四面体 sp3
< 正四面体 sp3 ![]() (任写一种) 分子晶体 5
(任写一种) 分子晶体 5 ![]() 6
6 ![]()
【解析】
(1)Fe为26号元素,根据核外电子排布规律作答;
(2)结合价层电子对互斥理论与杂化类型及等电子体原理分析;
(3)依据分子晶体的物理性质分析;结合中心铁原子的价电子数及配体CO提供的电子数列式计算;
(4)用“均摊法”,计算出晶胞中含Fe与N的个数比,得出化学式;
(5)该晶胞模型为面心立方堆积,结合空间构型回答;根据晶胞参数等于相邻两个离子核间距的2倍作答。
(1)Fe在第四周期VIII族,基态原子简化的电子排布式为:![]() 3d64s2,则
3d64s2,则![]() 简化的电子排布式为
简化的电子排布式为![]() ;Co基态原子简化的电子排布式为:
;Co基态原子简化的电子排布式为:![]() 3d74s2,气态Co失去三个电子后会变成
3d74s2,气态Co失去三个电子后会变成![]() ,更易生成
,更易生成![]() ,因为此时最高能级d能级为半充满结构较稳定,则第四电离能
,因为此时最高能级d能级为半充满结构较稳定,则第四电离能![]() ,故答案为:
,故答案为:![]() ;<;
;<;
(2)![]() 的价层电子对数=4+
的价层电子对数=4+![]() =4,无孤电子对,则其空间构型为正四面体,杂化类型为sp3;等电子体是指价电子数相同,原子数相同,结构相似的离子或分子,则与
=4,无孤电子对,则其空间构型为正四面体,杂化类型为sp3;等电子体是指价电子数相同,原子数相同,结构相似的离子或分子,则与![]() 互为等电子体的有
互为等电子体的有![]() (任写一种即可),故答案为:正四面体;sp3;
(任写一种即可),故答案为:正四面体;sp3;![]() (任写一种即可);
(任写一种即可);
(3)![]() 常温下呈液态;熔点为
常温下呈液态;熔点为![]() ,沸点为
,沸点为![]() ,易溶于非极性溶剂,符合分子晶体的物理性质,因此可判断
,易溶于非极性溶剂,符合分子晶体的物理性质,因此可判断![]() 为分子晶体;中心原子铁价电子数为8,配体CO提供2个电子形成配位键,因此x=(18-8)/2=5,故答案为:分子体;8;
为分子晶体;中心原子铁价电子数为8,配体CO提供2个电子形成配位键,因此x=(18-8)/2=5,故答案为:分子体;8;
(4)氮化铁晶胞为六棱柱,顶点贡献率为1/6,棱点贡献率为1/3,面点贡献率为1/2,观察晶胞可知,12个铁位于顶点,2个铁位于面心,3个铁位于体内,2个N位于体内,用“均摊法”可知,1个晶胞中含铁微粒数:12×1/6+2×1/2+3=6个,含氮微粒数:2个,该晶体中铁、氮的微粒个数之比为=6:2=3:1,则化学式为:![]() ;
;
(5)根据晶胞图可知,氧化亚铁晶胞类似氯化钠晶胞,棱上3个离子相切,晶胞参数等于相邻两个离子核间距的2倍。上、中、下三层各4个氧离子(共12个氧离子)与中心的氧离子紧邻且等距离,用“均摊法”,晶胞中含Fe2+:8×1/8+6×1/2=4个,含O2-:12×1/4+1=4个,晶胞的化学式为FeO,氧化亚铁中氧离子、亚铁离子个数比为1:1,所以,有6个O2-与Fe2+紧邻且等距离;
1个氧化亚铁晶胞中含4个FeO,设Fe2+与O2-的最短核间距为dpm,1molFeO的质量为72g,氧化亚铁晶体的密度为ρ gcm-3,则有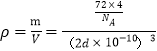 ,解得d=
,解得d=![]() pm,所以Fe2+与O2-的最短核间距为
pm,所以Fe2+与O2-的最短核间距为![]() pm,故答案为:6;
pm,故答案为:6;![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图:烧瓶中充满a气体,滴管和烧杯中盛放足量b溶液,将滴管中溶液挤入烧瓶,打开止水夹f,能形成喷泉的是( )
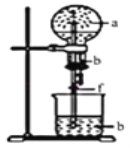
A.a是Cl2,b是饱和NaCl溶液
B.a是NO,b是H2O
C.a是HCl,b是H2O溶液
D.a是CO2,b是饱和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题:

(1)按照如图装置进行实验时,首先进行的操作是________。
(2)写出装置A中所发生反应的离子方程式 ___________。
(3)装置B中最适宜的试剂是_______(填序号)。
a. NaOH溶液 b. 水 c. 澄清石灰水 d. 饱和NaHCO3 溶液
(4)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是_______。
(5)装置D中黑色固体为木炭,反应的化学方程式为__________________________。
(6)根据实验中的__________________现象,可证明CO具有还原性。
(7)若要根据装置F中澄清石灰水变浑浊的现象确认CO具有还原性,应在上图装置____与_____之间连接下图中的_____装置(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的示意图如图所示。下列说法正确的是

A. 放电时,N为负极,其电极反应式:PbO2+SO42-+4H++2e-=PbSO4+2H2O
B. 放电时,c(H2 SO4)不变,两极的质量增加
C. 放电时,SO42-向M.N两个电极移动
D. 放电时,正极反应式:PbSO4+2e-=Pb+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素(Carbon group)包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)、鈇(Fl)六种。
(1)已知Sn为50号元素,其价电子排布式为 ______;价电子中成对电子数为______个。
(2)已知CO与N2的结构相似,则CO的电子式为______,C、O、N第一电离能由大到小的顺序为______,三者最简单氢化物的熔沸点高低顺序为 ______(用“化学式”表示)。
(3)甲硅烷(SiH4)可用来制取超纯半导体硅,工业上采用Mg2Si和NH4Cl在液氨介质中反应制得甲硅烷,该反应的化学方程式为___________。
(4)碳酸氢钠的溶解度小于碳酸钠,是由于HCO3-能够形成双聚或多聚链状离子的结果,HCO3-中C原子的杂化方式为_______,HCO3-能够双聚或多聚的原因是__________。
(5) SiC作为C和Si唯一稳定的化合物,每个Si(或C)原子与周边包围的C(Si)原子通过________杂化相互结合。已经发现SiC具有250多种型体。某立方系晶体其晶胞参数为apm,阿伏加德罗常数的值为NA,该晶胞中原子的坐标参数为:
C部分原子:(0,0,0);(![]() ,
,![]() ,0);(
,0);(![]() ,0,
,0,![]() );(0,
);(0,![]() ,
,![]() )
)
Si全部原子:(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() ,
,![]() );(
);(![]() ,
,![]() )
)
该立方晶胞中Si原子构成的空间构型为_______,晶体的密度可表示为________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是丁醇的两种同分异构体,其结构简式、沸点及熔点如下表所示:
异丁醇 | 叔丁醇 | |
结构简式 |
|
|
沸点/℃ | 108 | 82.3 |
熔点/℃ | -108 | 25.5 |
下列说法不正确的是
A. 用系统命名法给异丁醇命名为:2-甲基-1-丙醇
B. 异丁醇的核磁共振氢谱有三组峰,且面积之比是1∶2∶6
C. 用蒸馏的方法可将叔丁醇从二者的混合物中分离出来
D. 两种醇发生消去反应后得到同一种烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别将2mol SO2和1mol O2充入10L的容器中使之发生反应:2SO2+O2![]() 2SO3,并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变。若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变。若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com