
【题目】如图:烧瓶中充满a气体,滴管和烧杯中盛放足量b溶液,将滴管中溶液挤入烧瓶,打开止水夹f,能形成喷泉的是( )
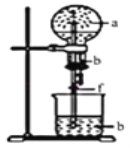
A.a是Cl2,b是饱和NaCl溶液
B.a是NO,b是H2O
C.a是HCl,b是H2O溶液
D.a是CO2,b是饱和NaHCO3溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:A.金刚石、B.MgF2、C.NH4Cl、D.NaNO3、E.干冰、F.固体碘,填写下列空白。(用序号填写)
(1)熔化时不需破坏化学键的是________,熔化时只需破坏共价键的是________,熔点最低的是________,
晶体中既存在离子键又存在共价键的是________。
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的ΔH=______ kJ·mol-1

(3) 50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。

请回答下列问题:
从实验装置上看,图中尚缺少的一种玻璃仪器是_____,烧杯间填满碎泡沫塑料的作用是______。大烧杯上如不盖硬纸板,则求得的中和热数值_______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述不正确的是
A. 常温常压下,1 mol氦气中含有的质子数为2NA
B. l0g46%乙醇水溶液中所含氧原子数为0.4NA
C. 1 Ll mol/LNa2CO3溶液中,阴离子总数小于NA
D. 浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:
2A(g)+B(g)![]() 2C(g) ΔH>0。
2C(g) ΔH>0。
达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )

选项 | x | y |
A | 再通入A | B的转化率 |
B | 加入催化剂 | A的体积分数 |
C | 压强 | 混合气体的总物质的量 |
D | 温度 | 混合气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃时,饱和氯化钾溶液的密度为1.174 g/mL,物质的量浓度为4.0 mol/L,则下列说法中正确的是
A.25 ℃时,饱和氯化钾溶液的浓度小于4.0 mol/L
B.此溶液中氯化钾的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于1.174 g/mL的氯化钾溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ·mol-1;S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1;Mn(s)+S(s)+2O2(g)===MnSO4(s) ΔH=-1 065 kJ·mol-1 SO2与MnO2反应生成无水MnSO4的热化学方程式是___________________________。
(2)已知:温度过高时,WO2(s)转变为WO2(g):①WO2(s)+2H2(g)![]() W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1②WO2(g)+2H2(g)
W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1②WO2(g)+2H2(g)![]() W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1;则WO2(s)W
W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1;则WO2(s)W![]() O2(g)的ΔH=______________
O2(g)的ΔH=______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:

已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3—![]() Ag++2SO
Ag++2SO![]()
ⅲ“分铜”时各元素的浸出率如下表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_______。
(2)“分金”时,单质金发生反应的离子方程式为________。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。

“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为_______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)已知Ksp[Ag2SO4]=1.4×10-5,沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度(假定溶液中Ag+浓度为0.1mol/L)。________。
(5)工业上,用镍为阳极,电解0.1 mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:

为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ/mol
D. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等过渡元素在工业生产和科学研究中具有重要作用,回答下列问题。
(1)![]() 简化的电子排布式为____________,第四电离能
简化的电子排布式为____________,第四电离能![]() ___
___![]() (填”>”或”<”)。
(填”>”或”<”)。
(2)![]() 常作净水剂和补铁剂,
常作净水剂和补铁剂,![]() 的空间构型为________,其中硫原子采用______杂化,任意写出一种
的空间构型为________,其中硫原子采用______杂化,任意写出一种![]() 的等电子体_______。
的等电子体_______。
(3)![]() 常温下呈液态;熔点为
常温下呈液态;熔点为![]() ,沸点为
,沸点为![]() ,易溶于非极性溶剂,据此可判断
,易溶于非极性溶剂,据此可判断![]() 晶体属于______(填晶体类型),若配合物
晶体属于______(填晶体类型),若配合物![]() 的中心原子价电子数与配体提供电子数之和为18,则
的中心原子价电子数与配体提供电子数之和为18,则![]() _________。
_________。
(4)氮化铁晶体的晶胞如图所示,该氮化铁晶体的化学式为______。

(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρ![]() ,
,![]() 代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的
代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的![]() 数目为________,
数目为________,![]() 与
与![]() 最短核间距为_________pm。
最短核间距为_________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com