
【题目】下列各组物质中,能用酸性高锰酸钾溶液鉴别的是( )
A. 乙烯、乙炔
B. 己烷、苯
C. 己烯、苯
D. 苯、甲苯
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】(1)用0.lmol·L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
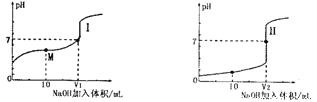
①滴定醋酸的曲线是__________(填“I”或“Ⅱ”)。
②V1和V2的关系:V1______V2(填“>”、“=”或“<”)
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。资料:AgSCN是白色沉淀
操作步骤 | 现象 |
步骤1:向2mL0.005mol·L-1AgNO3溶液中 加入2mL0.005mol·L-1KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取lmL上层清液于试管中,滴加1 滴2 mol·L-1Fe(NO3)3溶液 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3mol·L-1 AgNO3溶液 | 出现白色沉淀,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式______________________。
②用化学平衡原理解释步骤3的实验现象______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定Cl2、Br2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)。实验步骤如下图,填写图中的空白。
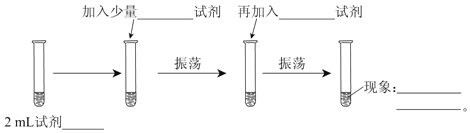
(1)2 mL试剂_______________;
(2)加入少量___________试剂;
(3)再加入___________试剂;
(4)现象_____________________________________________________。
(5)可以证明Cl2的氧化性____________(填强于、弱于)Br2的氧化性。
(6)发生反应的离子反应方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲将NaCl、CaCO3分离,可能会涉及如下操作步骤:
①溶解②过滤③蒸发结晶④洗涤⑤烘干⑥萃取,其中正确的是( )
A.①②③B.②③④⑤
C.①②③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.淀粉、纤维素、油脂的相对分子质量都较大,所以都属于高分子化合物
B.苯、乙酸、乙醇在一定条件下都能发生取代反应,且都能与金属钠反应
C.乙烯能使酸性高锰酸钾和溴水褪色,二者反应原理相同
D.等物质的量的乙烷和乙醇完全燃烧时所需氧气的质量不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO
②HCl、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):
A________;B________;C _________
(2)这三种物质相互作用可生成一种新物质NaHCO3,该反应________(填“是”或“不是”)氧化还原反应。
(3)写出物质C与足量稀硫酸反应的离子方程式:_____________________________
(4)HCO![]() 与H+、OH-在溶液中都不能大量共存,试用离子方程式说明______________________
与H+、OH-在溶液中都不能大量共存,试用离子方程式说明______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关离子浓度及pH大小的比较,正确的是( )
A. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
【答案】D
【解析】①(NH4)2Fe(SO4)2溶液中Fe2+的水解对于铵根离子的水解起到抑制作用, ②(NH4)2CO3 中碳酸根离子水解对于铵根离子的水解起到促进作用,③(NH4)2SO4溶液中硫酸根离子对铵根离子的水解无影响,所以溶液中铵根离子的水解程度的大小顺序为:②>③>①。则要达到相同的铵根离子浓度,水解程度大的溶液,物质的浓度应该越大,即溶液浓度由大到小的顺序是:②>③>①。选项A错误。由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,由于醋酸的浓度远大于氢氧化钠的浓度,所以中和以后得到醋酸钠(较少)和醋酸(较多)的混合溶液,溶液显酸性,即c(H+)>c(OH-),根据电荷守恒得到:c(CH3COO-)>c(Na+)。又因为钠离子是醋酸钠完全电离生成的,氢离子使醋酸微弱电离得到的,所以有c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。选项B错误。pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合,两溶液的氢氧根离子和氢离子的浓度刚好相等,等体积混合,恰好中和,溶液显中性。选项C错误。pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,其![]() ,所以
,所以![]() ,
, ![]() ,选项D正确。
,选项D正确。
【题型】单选题
【结束】
14
【题目】室温下,下列溶液中粒子浓度关系正确的是( )
A. Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4)
B. 20mL0.1molL-1CH3COONa溶液与10mL0.1molL-1HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D. pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列甲、乙、丙三图,判断下列叙述不正确的是( )
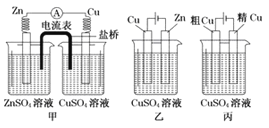
A. 甲是原电池,乙是电镀装置 B. 甲、乙装置中,锌极上均发生氧化反应
C. 乙、丙装置中,阳极均发生氧化反应而溶解 D. 丙装置中,铜电极的质量有增有减
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com