
【题目】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
(1)第四周期过渡元素的明显特征是形成多种多样的配合物.
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C,O原子都符合8电子稳定结构,CO的结构式为__,与CO互为等电子体的离子为__(填化学式).
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列___________.
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是__,Ga的第一电离能却明显低于Zn,原因是__.
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是__.
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形.
【答案】C≡O CN﹣ ②bc 1s22s22p63s23p63d104s24p1 Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga d
【解析】
(1)①CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则C、O之间为三键;等电子体中原子数和价电子数都相同;
②根据结构相似相溶原理分析,非极性溶质易溶于非极性溶剂;
(2)镓是31号元素,根据核外电子排布式的书写规则书写;根据价电子排布判断电离能的大小;
(3)根据价层电子对互斥理论来判断。
(1)①CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则CO的结构式为C![]() O,等电子体中原子数和价电子数都相同,1molCO中含2mol原子,含10mol价电子,CN-的原子数是2,价电子数都是10,则互为等电子体,
O,等电子体中原子数和价电子数都相同,1molCO中含2mol原子,含10mol价电子,CN-的原子数是2,价电子数都是10,则互为等电子体,
因此,本题正确答案是:C≡O ;CN﹣;
②水为极性分子,硫酸镍溶液为离子化合物溶液,Ni(CO)4中Ni采取sp3杂化,是正四面体结构,所以属于非极性分子,根据相似相溶原理,非极性溶质易溶于非极性溶剂,苯和四氯化碳是非极性分子,所以Ni(CO)4易溶于苯和四氯化碳,
因此,本题正确答案是:bc;
(2)镓是31号元素,该原子核外有31个电子,4S能级能量小于3d能级能量,根据能量最低原理,电子先排4s能级后排3d能级,所以铜的核外电子排布式为1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,价电子中3d、4s轨道为全充满状态,原子较稳定,故Zn的第一电离能大于Ga,
因此,本题正确答案是:1s22s22p63s23p63d104s24p1;Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga;
(3) H2Se分子的中心原子Se原子上含有2个![]() 键,中心原子上的孤电子对数=
键,中心原子上的孤电子对数=![]() =4,所以H2Se分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
=4,所以H2Se分子的VSEPR模型是四面体型,略去孤电子对后,实际上其空间构型是V型;
BBr3分子的中心原子B原子上含有3个![]() 键,中心原子上的孤电子对数=
键,中心原子上的孤电子对数=![]() =3,所以BBr3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形。
=3,所以BBr3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形。
故答案选d。


科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是
A. 质子数和中子数均为6的碳原子:![]() B. 硫离子的结构示意图:
B. 硫离子的结构示意图:![]()
C. 氢氧化钠的电子式:![]() D. 乙烯的结构简式:CH2CH2
D. 乙烯的结构简式:CH2CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示:

下列关于该化合物的说法正确的是 ( )
A. 分子式为C16H25O
B. 含有苯环结构
C. 该物质1mol一定条件下最多能与3mol氢气反应
D. 分子中含有一种含氧官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(l)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是________,B原子的杂化轨道类型是_____________。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/ kJ·mol-1 | I2/ kJ·mol-1 | I3/ kJ·mol-1 | I4/ kJ·mol-1 | I5/ kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____ (填元素符号),判断理由为________________________。
(2)铜晶体中铜原子的堆积方式如图24所示,铜晶体中原子的堆积模型属于______。

(3)A原子的价电子排布式为3s23p5,铜与A形成化合物的晶胞如图25所示(黑点代表铜原子)。
①该晶体的化学式为______________________。
②该化合物难溶于水但易溶于氨水,其原因是_______________________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______________________。
③已知该晶体的密度为pg . cm-3,阿伏伽德罗常数为NA,已知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4) 2 ·12H2O]易溶于水,不易溶于乙醇,在生产、生活中有广泛用途。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量的SiO2、FeO·xFe2O3)制备明矾的工艺流程如下:

回答下列问题:
(1)酸浸时为提高铝的浸取率,可采取的措施是_________(填标号)。
a.改用同浓度的硝酸 b.用硫酸多次浸取
c.浸取时间缩短一半 d.适当升高温度
(2)滤渣1的成分是__________;滤渣2经过处理可以制得一种高效的无机高分子混凝剂,其化学式为[Fe2(OH)n(SO4)(3-0.5n)]m,则该物质中铁元素的化合价为___________。
(3)检验滤液A中含有Fe2+的实验方案及现象是________________________________________。
(4)已知常温下Ksp[Fe(OH)3]=4.0×10-38,当调节溶液的pH=3时,溶液中c(Fe3+)=____________。
(5)操作Ⅱ中包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,使用酒精洗涤明矾晶体的目的是___________________________________________________________________;明矾净水的原理是_______________________________________(写离子方程式)。
(6)已知在pH=3和加热条件下,MnO4-可与Mn2+反应生成MnO2,则上述流程图中加入适量MnSO4发生反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物H的合成路线如下:

已知:i. 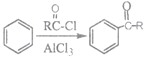
ii. 
回答下列问题
(1)A的化学名称为___________。
(2)B→C的化学方程式为______________________。
(3)E的结构简式为___________;由E生成F的反应类型为______________________。
(4)G中官能团名称为___________;由G→H的化学方程式为______________________。
(5)芳香族化合物L与G的官能团相同,但L的相对分子质量比G小28。则符合下列条件的L的同分异构体有___________种。
①与FeCl3溶液发生显色反应 ②苯环上有3个取代基
(6)按 有机合成路线可以制备
有机合成路线可以制备 。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色。则以下说法正确的是

A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到
cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到
原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是
A. 平衡向正反应方向移动 B. (a+b)>(c+d)
C. Z的体积分数变大 D. X的转化率变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com