
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.
(1)现有下列6种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2.按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①____________________________________________________________________.
②____________________________________________________________________.
(2)从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式:______________________________________________________________________、______________________________________________________________________.
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系:______________________.
(4)生活中的食醋和淀粉溶液分别属于分散系中的______和________,用________可以鉴别(填化学专用名词).
科目:高中化学 来源: 题型:
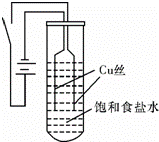
某校化学研究性学习小组以铜为电极电解饱和食盐水,探究过程如下:
【实验Ⅰ】如图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,但溶液始终未出现蓝色.
【实验Ⅱ】将实验Ⅰ中试管底部的橙黄色沉淀取出,分装在两支小试管中,沉淀很快转变为砖红色,后续的操作及现象如下:
| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸 | 砖红色沉淀溶解,有无色气泡产生,最终得到蓝色溶液 |
| ② | 滴入稀硫酸 | 砖红色沉淀转变为紫红色不溶物,溶液呈蓝色 |
已知常见铜的化合物颜色如下:
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色 | 氯化亚铜 | 白色 |
请回答下列问题:
(1)铜的常见化合价为 +1 、 +2 ;聚集在试管底部的橙黄色沉淀的化学式为 Cu2O .
(2)阳极的电极反应式为 2Cu+2Cl﹣﹣2e﹣=2CuCl↓ .
(3)写出实验Ⅱ中①、②的离子方程式:① 3Cu2O+2H++2NO3﹣=6Cu2++2NO↑+7H2O ;② Cu2O+2H+=Cu+Cu2++H2O .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是 ( )
A.用醋酸除水垢:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.向溴化亚铁溶液中通入足量氯气:2Br-+Cl2=Br2 +2Cl-
D.向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的HCl气体8.96L溶于水形成100mL溶液,然后与足量的铁屑充分反应。计算:(要有计算过程,只有结果计零分)
(1)所得盐酸溶液的物质的量浓度。
(2)参加反应的铁的质量;生成H2的体积(标况)
(3)将生成的FeCl2配成400ml溶液,此溶液中FeCl2的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
在日常生活中出现了“加碘食盐”、“增铁酱油”、“富硒茶叶”、“含氟牙膏”等名词,这里的碘、铁、硒、氟,应理解为( )
|
| A. | 元素 | B. | 单质 | C. | 氧化物 | D. | 分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质用途的说法中,正确的是( )
①硅可用来制造半导体材料 ②二氧化硅可用于制造光导纤维
③碳酸氢钠可用于治疗胃酸过多 ④铝合金可用于制造飞机.
|
| A. | 只有①② | B. | 只有③④ | C. | 只有②③④ | D. | ①②③④都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
大气污染日益严重,改善大气质量迫在眉睫.
(1)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源.冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂﹣钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的氧化.
①写出CO与NO反应的化学方程式: .
②“催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是 .
③控制城市污染源的方法是 (填字母).
a.使用绿色能源 b.带上呼吸面具 c.植树造林
(2)酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标.某兴趣小组同学取刚降落在热电厂附近的雨水进行实验.
Ⅰ、测得该雨水样品的pH为4.73;
Ⅱ、向雨水样品中滴加BaCl2溶液,有白色沉淀生成;
Ⅲ、每隔1h,通过pH计测定雨水样品的pH,测得的结果如表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
根据以上信息,回答下列问题:
①正常雨水的pH为5.6,偏酸性,这是因为 .
②分析上述数据变化,你认为形成这一变化的原因是 .
③兴趣小组同学取某一时段的这种雨水V L,加入0.5mol•L﹣1的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00mL Ba(OH)2溶液.请计算:
a.该V L雨水中溶解SO2的体积(标准状况).
b.生成沉淀物的质量范围为 .(列出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.NaHCO3与石灰水反应,当n(NaHCO3)∶n[Ca(OH)2]=3∶1时,溶液中无HCO3-
B.CO2通入石灰水中,当n(CO2)∶n[Ca(OH)2]=1∶1时,能得到澄清溶液
C.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42- BaSO4↓+2H2O
BaSO4↓+2H2O
D.向碳酸氢钠溶液中滴入过量澄清石灰水:Ca2++OH-+HCO3- CaCO3↓+H2O
CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com