
某校化学研究性学习小组以铜为电极电解饱和食盐水,探究过程如下:
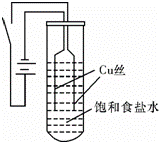
【实验Ⅰ】如图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细.电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10.随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,但溶液始终未出现蓝色.
【实验Ⅱ】将实验Ⅰ中试管底部的橙黄色沉淀取出,分装在两支小试管中,沉淀很快转变为砖红色,后续的操作及现象如下:
| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸 | 砖红色沉淀溶解,有无色气泡产生,最终得到蓝色溶液 |
| ② | 滴入稀硫酸 | 砖红色沉淀转变为紫红色不溶物,溶液呈蓝色 |
已知常见铜的化合物颜色如下:
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色 | 氯化亚铜 | 白色 |
请回答下列问题:
(1)铜的常见化合价为 +1 、 +2 ;聚集在试管底部的橙黄色沉淀的化学式为 Cu2O .
(2)阳极的电极反应式为 2Cu+2Cl﹣﹣2e﹣=2CuCl↓ .
(3)写出实验Ⅱ中①、②的离子方程式:① 3Cu2O+2H++2NO3﹣=6Cu2++2NO↑+7H2O ;② Cu2O+2H+=Cu+Cu2++H2O .
| 电解原理. . | |
| 专题: | 电化学专题. |
| 分析: | (1)根据氯化铜、氧化亚铜判断铜的化合价;根据固体颜色判断试管底部橙黄色沉淀的物质成分; (2)根据放电顺序及实验现象判断生成物,并写出电极反应式; (3)根据实验现象确定生成物并写出相应的离子方程式. |
| 解答: | 解:(1)氯化铜中铜的化合价为+2价,氧化亚铜中铜的化合价为+1价,所以铜的常见正化合价为+1、+2;根据常见铜的化合物颜色判断,试管底部橙黄色沉淀的物质是Cu2O,故答案为:+1;+2;Cu2O; (2)电解时,铜作阳极,阳极上铜失电子生成亚铜离子进入溶液,亚铜离子和氯离子生成氯化亚铜白色沉淀,所以电极反应式为2Cu+2Cl﹣﹣2e﹣=2CuCl↓, 故答案为:2Cu+2Cl﹣﹣2e﹣=2CuCl↓; (3)①根据实验现象及硝酸和氧化亚铜的性质、及常见铜的化合物颜色判断,生成物是一氧化氮、硝酸铜和水,所以离子方程式为3Cu2O+2H++2NO3﹣=6Cu2++2NO↑+7H2O,故答案为:3Cu2O+2H++2NO3﹣=6Cu2++2NO↑+7H2O; ②根据实验现象及常见铜的化合物颜色,生成物是铜、硫酸铜和水,所以离子方程式为Cu2O+2H+=Cu+Cu2++H2O,故答案为:Cu2O+2H+=Cu+Cu2++H2O. |
| 点评: | 本题以电解原理为载体考查了铜的常见化合物的性质及颜色,本题只有结合铜的常见化合物颜色才能正确解答. |


科目:高中化学 来源: 题型:
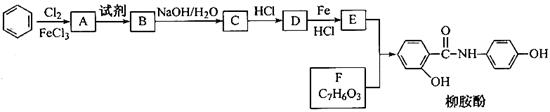
某课题组以苯为主要原料,采用以下路线合成利胆药—柳胺酚。
 |
 已知:。 请回答下列问题:
已知:。 请回答下列问题:
(1)对于柳胺酚,下列说法正确的是 。
A.1 mol柳胺酚最多可以和2 molNaOH反应 B.不发生硝化反应
C.可发生水解反应 D.可与溴发生取代反应
(2)写出A→B反应所需的试剂 。
(3)写出B→C的化学方程式 。
(4)写出化合物F的结构简式 。
(5)写出同时符合下列条件的F的同分异构体,其结构简式为
(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列哪种说法可以证明反应.N2+3H2 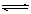 2NH3已达到平衡状态 ( )
2NH3已达到平衡状态 ( )
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有2个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
美国斯坦福大学研究人员发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl.下列有关“水”电池在海水中放电时的说法正确的是( )
|
| A. | 负极反应式:Ag+Cl﹣+e﹣═AgCl |
|
| B. | 电池的正极用二氧化锰纳米棒为材料,可大大提高发电效率 |
|
| C. | Na+不断向“水”电池的负极移动 |
|
| D. | 每转移2 mol电子,正极就有5 mol MnO2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
目前市场上的手提应急灯,主要用的是“无液干粉”铅酸蓄电池,其原理是将强腐蚀性的浓硫酸灌注到硅胶中,使电解质溶液不易发生泄漏,大大改善了电池的性能.所用的原料仍然是Pb﹣PbO2﹣H2SO4,下列关于该铅酸蓄电池的说法正确的是( )
|
| A. | 充电时,电源的正极接蓄电池标“+”的一极,电池上标有“﹣”的一极发生氧化反应 |
|
| B. | “无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理 |
|
| C. | 放电时,在铅酸蓄电池的负极发生还原反应 |
|
| D. | 若用此铅酸蓄电池电解饱和NaCl溶液,标准状况下制备1.12LCl2,电池内至少消耗H2SO40.10 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于溶液中微粒的浓度,下列说法正确的是
A.0.1mol·L-1的(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-)
B.等浓度等体积的NaHSO3溶液与NaClO溶液混合后:
c(Na+) + c(H+) = c(HSO3-) + c(ClO-) + 2c(SO32-) + c(OH-)
C.等浓度等体积的NaHCO3溶液与NaCl溶液混合后:
1/2 c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3)
D.标况下,将2.24LSO2气体通入到100ml 1mol·L-1的NaOH溶液中,完全反应
后溶液呈酸性,则该溶液中:c(Na+) > c(HSO3-) > c(SO32-) >c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ. 在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 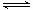 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12[来源:Z§xx§k.Com] | 0.11 | 0.10 | 0.10 |
(1)反应前2min的平均速率ν(Z)= ,该温度下此反应的平衡常数K=
(2)其他条件不变,若降低温度,反应达到新平衡前ν(逆) ν(正) (填“>”,“<”或“=”)
(3)其他条件不变,若再充入0.2molZ,平衡时X的体积分数 (填“增大”,“减小”或“不变”)
Ⅱ. 某电解池装置如下图所示:
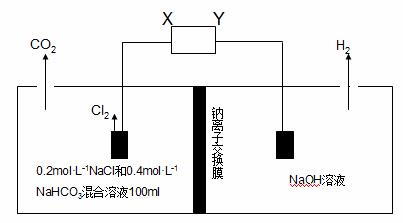
(1)外电源的负极是 (填“X”或“Y”)
(2)阳极室中发生的反应依次为 ,
(3)若外电路转移0.02mol电子,则膜两侧溶液质量变化差△m左 – △m右= g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子组在溶液中可以大量共存的是( )
|
| A. | pH=0的溶液中:Na+、CH3COO﹣、Cl﹣、Cu2+ |
|
| B. | pH=14的溶液中:H+、NH4+、SO42﹣、SO32﹣ |
|
| C. | 使pH试纸变红的溶液中:Fe2+、CO32﹣、NO3﹣、Cl﹣ |
|
| D. | 强酸性澄清透明溶液中:Al3+、K+、NO3﹣、MnO4﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.
(1)现有下列6种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2.按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①____________________________________________________________________.
②____________________________________________________________________.
(2)从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式:______________________________________________________________________、______________________________________________________________________.
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系:______________________.
(4)生活中的食醋和淀粉溶液分别属于分散系中的______和________,用________可以鉴别(填化学专用名词).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com