
【题目】向1LpH=2的盐酸和醋酸溶液中,分别投入0.65g锌粒,则图中比较符合客观事实的是( )
A.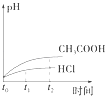
B.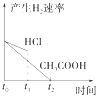
C.
D.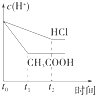
【答案】C
【解析】解:A.刚开始时,溶液的pH值为2,由于醋酸电离平衡的存在,反应过程中氢离子浓度大于盐酸溶液中氢离子浓度,所以醋酸反应速率始终大于盐酸反应速率,反应后,醋酸有剩余,导致反应过程中醋酸溶液pH始终小于盐酸溶液,故A错误;
B.反应开始氢离子浓度相同,反应速率相同.曲线从相同速率开始反应,但醋酸溶液中存在电离平衡,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以醋酸溶液反应过程中反应速率快,故B错误;
C.产生氢气的量从0开始逐渐增多,最终由于醋酸电离平衡的存在,生成氢气的量比盐酸多,反应过程中氢离子浓度大于盐酸溶液中氢离子浓度,和同量锌反应速率快,故图象符合题意,故C正确;
D.反应开始氢离子浓度相同,反应过程中醋酸存在电离平衡,醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,故D错误;
故选C.
【考点精析】通过灵活运用弱电解质在水溶液中的电离平衡,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理即可以解答此题.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.1000mol/L盐酸分别滴定20.00mL浓度均为0.1000mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积V[HCl(aq)]的变化关系如图所示。下列说法正确的是

A. Ⅰ表示是滴定氨水的曲线,V[HCl(aq)]=20mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. pH=7时,两种溶液中:c(Na+)=c(NH4+)
C. 滴定氢氧化钠溶液,V[HCl(aq)]>20mL时可能有c(Cl-)>c(Na+)>c(H+)>c(OH-)
D. 消定氨水时,当V[HCl(aq)]=10mL时,有2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述,正确的是( )
A.在饱和氯化铁溶液中逐滴加入NaOH溶液,可制备氢氧化铁胶体
B.明矾净水利用了胶体的吸附性
C.电泳现象可以证明胶体带电
D.胶体粒子很小,可以透过滤纸和半透膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大最的热。氢气燃烧生成水蒸气的能最变化如下图所示:

根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着______变化,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是_______kJ。
(2)下列化学反应在理论上可以设计成原电池的是________。
A.Fe+2FeCl3=3FeCl2 B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

a.电流计指针偏转 |
b.Cu极有H2产生 |
c.H+向负极移动 |
d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是_______(填序号)。
②请写出该电池的负极反应式_________。
③若有1mol电子流过导线,则理论上产生H2的质量为______g.
④将稀H2SO4换成CuSO4溶液,电极质量增加的是______(填“锌极”或“铜极”,下同),溶液中SO42-移向_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
![]()
冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
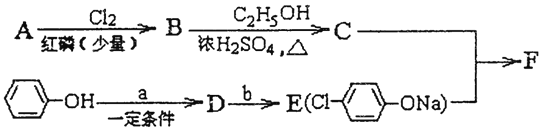
(1)A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24LCO2(标准状况),A的分子式为_________。
(2)写出符合A分子式的所有甲酸酯的结构简式:____________。
(3)B是氯代羧酸,其核磁共振氢谱有两个峰,写出B→C的反应方程式:_______。
(4)C+E→F的反应类型为___________。
(5)写出A和F的结构简式:A______;F_______
(6)D的苯环上有两种氢,它所含官能团的名称为________;写出a、b所代表的试剂:a. _______b. _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= .
(2)该反应为反应(选填“吸热”、“放热”).
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2molL﹣1、2molL﹣1、4molL﹣1、4molL﹣1 , 则此时上述反应的平衡移动方向为 . (选填“正反应方向”、“逆反应方向”、“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol H2O2放出热量98kJ。在含有少量I-的溶液中,H2O2分解机理为:
H2O2 + I- ![]() H2O + IO- 慢
H2O + IO- 慢
H2O2 + IO- ![]() H2O + O2 + I- 快
H2O + O2 + I- 快
下列说法正确的是
A. IO-是该反应的催化剂 B. 反应的速率与I-浓度有关
C. ν(H2O2) =ν(H2O) =ν(O2) D. 反应活化能等于98kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应2SO3(g)![]() 2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
A. 0~5min,O2的生成速率v(O2)=0.06mol·L-1·min-1
B. 若起始时充入3molSO3,起始时SO3分解速率不变
C. 若某时刻消耗了0.5molSO3同时生成了0.25molO2,则表明该反应达到了平衡状态
D. 达到平衡时,SO2和SO3的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下下列溶液中确关微粒的物质的量浓度关系正确的是
A. 等物质的量浓度的CuSO4和(NH4)2SO4的混合溶液![]()
B. 0.2 mol/L NaHCO3溶液和0.1 mol/LNaOH溶液等体积相混合:![]()
C. pH=2的盐酸与pH=12的氨水等体积混合![]()
D. 0.1 mol/LCH3COONa溶液中通入HC1气体,至pH=7(溶液体积变化忽略不计):![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com