
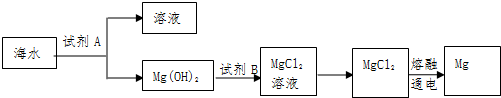
 请回答下列问题:
请回答下列问题:分析 Ⅰ.甲烷气体和氧气反应放出的能量可以直接转化成电能形成原电池反应,甲烷在负极上失电子发生氧化反应,氧气在正极上得到电子生成氢氧根离子;
Ⅱ.通电一段时间后,b电极变粗,说明溶液中的阳离子在b电极上得电子,所以b电极是阴极,则a、c是阳极,d是阴极,M是原电池正极,N是负极;
(1)根据以上分析确定M的电极;
(2)电解池阴极上析出银,根据转移电子数计算生成银的质量;
(3)M为正极,N为负极,则d为阴极,c为阳极,电解饱和食盐水阳极生成氯气,阴极生成氢气,溶液中生成氢氧化钠.
解答 解:Ⅰ.甲烷气体和氧气反应放出的能量可以直接转化成电能形成原电池反应,甲烷在负极上失电子发生氧化反应,氧气在正极上得到电子生成氢氧根离子,a为负极,电极反应为:CH4-8e-+10OH-=CO32-+7H2O,b电极为正极,电极反应为:O2+4e-+2H2O=4OH-,
故答案为:负;CH4-8e-+10OH-=CO32-+7H2O;O2+4e-+2H2O=4OH-;
Ⅱ.(1)根据题意知,电极a、b上没有气体生成,则a作阳极,b为阴极,所以M是原电池正极,故答案为:正;
(2)电解稀硫酸反应时,当通电一段时间后,c、d两极共收集到336mL气体(标准状况),则阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,电池反应式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,根据方程式知,生成氢气的体积占总体积的$\frac{2}{3}$所以混合气体中氢气的体积是224mL,根据2H++2e-═H2↑知,转移电子的物质的量是0.02mol,串联电解池中转移电子数相等,电镀池阴极上析出银的质量为
Ag++e-=Ag
1mol 108g
0.02mol 2.16g
故答案为:银;2.16;
(3)M为正极,N为负极,则d为阴极,c为阳极,电解饱和食盐水阳极生成氯气,阴极生成氢气,溶液中生成氢氧化钠,反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:阳极;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
点评 本题以电解池原理为载体考查了物质的量的有关计算、原电池正负极的判断等知识点,明确发生的电极反应及电子守恒是解答本题的关键,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: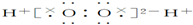 | |
| B. | NH4I的电子式: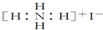 | |
| C. | 原子核内有10个中子的氧原子:1810O | |
| D. | CO2分子的结构式:O═C═O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应物总能量大于生成物总能量则反应为放热反应 | |
| B. | 电池工作时将化学能转变成电能 | |
| C. | 绿色植物光合作用过程中太阳能转变成化学能 | |
| D. | 生物质能只能通过含有生物质能的物质的直接燃烧转化成热能从而被利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
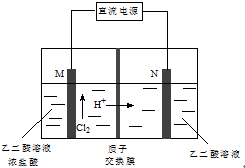 乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法正确的是( )| A. | M极与直流电源的负极相连 | |
| B. | 若有2 molH+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol | |
| C. | N电极上的电极反应式:HOOC-COOH-2e-+2H+=HOOC-CHO+H2O | |
| D. | 乙二醛与M电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O=HOOC-CHO+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液 | B. | BaCl2溶液 | C. | Ba(OH)2溶液 | D. | Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com