
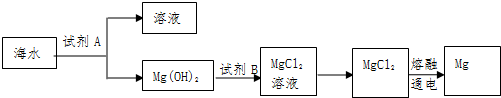
分析 (1)海水中加入试剂A为氢氧化钙,沉淀镁离子生成氢氧化镁沉淀,过滤后在沉淀中 加入盐酸溶解得到氯化镁溶液,通过蒸发浓缩、冷却结晶过滤洗涤得到氯化镁晶体,在氯化氢气流中失水得到固体氯化镁,电解熔融氯化镁得到金属镁,
工业上常用石灰乳或氧化钙和镁离子反应生成Mg(OH)2;氢氧化镁和盐酸反应得到氯化镁和水;
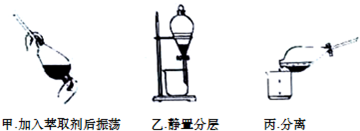
(2)干海带在坩埚内灼烧得到海带灰,加入水溶解过滤后在滤液中加入酸化的过氧化氢得到含碘单质的溶液,加入四氯化碳萃取分液,蒸馏得到碘单质,
①灼烧固体时所用的主要仪器名称是坩埚;
②分离时先分离下层液体.
解答 解:(1)①工业上常用石灰乳或氧化钙沉淀Mg2+,CaO和H2O反应生成Ca(OH)2,Ca(OH)2和镁离子反应生成Mg(OH)2;氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,所以离子方程式为Mg(OH)2+2H+=Mg2++2H2O,
故答案为:石灰乳或氧化钙;Mg(OH)2+2H+=Mg2++2H2O;
(2)①灼烧固体时所用的主要仪器名称是坩埚,故答案为:坩埚;
②振荡、静置分层操持合理,而分离时先分离下层液体后倒出上层液体,则丙图不合理,故答案为:丙.
点评 本题考查了海水资源的综合运用,根据化学反应的概念及流程图中物质的性质来分析解答,侧重分离和萃取的考查,题目难度不大.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+O2(g)→CO2(g)+393kJ | B. | C+O2→CO2+393kJ | ||
| C. | C(s)+O2(g)→CO2(g)-393kJ | D. | C(s)+1/2O2(g)→CO(g)+393kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
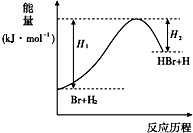
| A. | 正反应为放热反应 | |
| B. | 反应物总能量高于生成物总能量 | |
| C. | 升高温度可增大正反应速率,降低逆反应速率 | |
| D. | 加入催化剂,该化学反应的反应物的总能量与生成物的总能量差不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
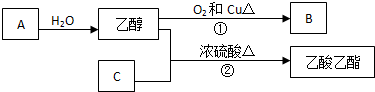
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请回答下列问题:
请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com