
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,17g甲基(14CH3)所含的中子数为9NA
B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO42- 数为0.2NA
C.0.1mol N2与足量的H2反应,转移的电子数为0.6NA
D.用惰性电极电解1L0.1mol·L-1 CuCl2溶液,当有0.3NA个电子通过时,可生成6.4g铜
D
【解析】
试题分析:A.甲基(14CH3)中含有的中子数是14—6=8,常温常压下,17g甲基(14CH3)的物质的量是17g÷17g/mol=1mol,则所含的中子数为8NA,A错误;B.1 L 0.2 mol·L-1硫酸铁溶液中硫酸根的浓度是0.6mol/L,则溶液中含有的SO42- 数为0.6NA,B错误;C.合成氨反应是可逆的,则0.1mol N2与足量的H2反应,转移的电子数小于0.6NA,C错误;D.用惰性电极电解1L0.1mol·L-1 CuCl2溶液,阴极铜离子放电,电极反应式为Cu2++2e—=Cu,由于铜离子的物质的量是0.1mol,因此当有0.3NA个电子通过时,铜离子全部放电,然后又有0.1mol氢离子再放电,即2H++2e—=H2↑,所以生成6.4g铜,D正确,答案选D。
考点:考查阿伏加德罗常数计算


科目:高中化学 来源:2014-2015学年河北省等五校高三上学期第二次联考理综化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关。对下列现象或事实解释错误的是
选项 | 现象或事实 | 解释 |
A | 明矾用于净水 | 铝离子水解产生的胶体具有很强吸附杂质的作用 |
B | SO2能使品红溶液褪色 | SO2具有漂白性 |
C | “地沟油”禁止食用,但可以用来制肥皂 | “地沟油”主要成分为油脂属于酯类可以发生皂化反应 |
D | 用氯水和淀粉溶液鉴别食盐是否加碘 | 目前加碘食盐中含碘元素物质为KI |
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述与电化学腐蚀无关的是
A.切过咸菜的菜刀不及时清洗易生锈
B.线路连接时,有经验的电工从不把铝导线和铜导线接在一起
C.银质奖章久置后表面逐渐变暗
D.在轮船的尾部和船壳的水线以下,常装有一定数量的锌块
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省濉溪县高三第二次月考化学试卷(解析版) 题型:选择题
向FeI2、FeBr2的混合溶液中通入适量的氯气,溶液中某些离子的物质的量变化如下图所示。下列有关说法中正确的是
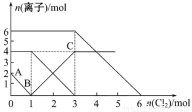
A.离子的还原性顺序为:Fe2+>I->Br-
B.原混合溶液中FeBr2的物质的量为4mol
C.原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=1∶2∶3
D.当通入2 mol Cl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省濉溪县高三第二次月考化学试卷(解析版) 题型:选择题
实验室中某些气体的制取、除杂及收集装置如图所示。仅用此装置和表中提供的物质完成相关实验,最合理的是
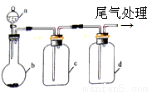
选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
A | 浓氨水 | CaO | 浓H2SO4 | NH3 |
B | 浓盐酸 | MnO2 | 饱和NaCl溶液 | Cl2 |
C | 饱和食盐水 | Na2O2 | CuSO4溶液 | O2 |
D | 浓硫酸 | Na2SO3 | 浓H2SO4 | SO2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:填空题
X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | 双原子分子单质在标准状况下密度为1.429g/L |
Z | 单质及其化合物的焰色反应为黄色 |
W | W元素基态原子的M层全充满,N层只有一个电子 |
(1)X位于元素周期表位置为第第__________周期第_________族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
(2)X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 的 键和
键和 键的个数比是 。
键的个数比是 。
(3)Z2Y2中含有的化学键类型有 ;W的基态原子核外电子排布式是 。
(4)废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
①A(s)+H2SO4 (aq) == ASO4 (aq) + H2(g) ΔH=+64.4kJ·mol-1
②2H2O2(l) == 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
③H2(g)+ O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示): 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:选择题
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O===2NO+HNO3+9HF。下列有关该反应的说法正确的是
A.NF3分子中所有原子共平面
B.NF3在反应中既做氧化剂又做还原剂
C.生成0.2mol HNO3时转移0.2mol电子
D.氧化产物与还原产物的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中化学试卷(解析版) 题型:选择题
下列叙述中正确的是
A.液溴应保存于带磨口玻漓塞的广口试剂瓶中,并加水“水封”以减少其易挥发
B.向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
C.滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无
D.氨气是一种碱性气体,可用P2O5或无水CaCl2干燥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北大冶一中等六校高三元月调考理综化学试卷(解析版) 题型:填空题
(13分)X、Y、Z、W四种常见元素,且均为短周期元素。已知:①X的最高价氧化物对应的水化物为无机酸中最强酸;②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料;③ Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料;④W被称为军事金属,可在CO2中燃烧。
(1)X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(2)Z的氧化物在通信领域用来作 ,工业上制Z单质的化学反应方程式为 。
(3)在50mLlmol·L-1的YX3溶液中逐滴加入0.5mol·L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积最多为 mL。
(4)Y、W合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某Y、W合金(设不含其他元素)中W的质量分数,设计下列实验方案进行探究。称量x g Y、W合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。欲计算W的质量分数。该实验中还需测定的数据是 。 若用空气代替O2进行实验,对测定结果是否有影响?若有影响分析其原因 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com