
X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
元素 | 相关信息 |
X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
Y | 双原子分子单质在标准状况下密度为1.429g/L |
Z | 单质及其化合物的焰色反应为黄色 |
W | W元素基态原子的M层全充满,N层只有一个电子 |
(1)X位于元素周期表位置为第第__________周期第_________族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
(2)X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 的 键和
键和 键的个数比是 。
键的个数比是 。
(3)Z2Y2中含有的化学键类型有 ;W的基态原子核外电子排布式是 。
(4)废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
①A(s)+H2SO4 (aq) == ASO4 (aq) + H2(g) ΔH=+64.4kJ·mol-1
②2H2O2(l) == 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
③H2(g)+ O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示): 。
(14分)
(1)二 IV A (分) 原子(每空1分)
(2)O (1分) 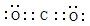 (2分) 1:1(1分)
(2分) 1:1(1分)
(3)离子键、非极性键(或共价键) (2分) [Ar]3d104s1 (2分)
(4)Cu (s) + H2O2(l) + H2SO4(aq) = CuSO4(aq) + 2H2O (l) H = - 319.6 kJ / mol (3分)
【解析】
试题分析:X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,则X的核外电子排布是1s22s22p2,所以X是C元素;Y的双原子分子单质在标准状况下密度为1.429g/L,则相对分子质量是1.429×22.4=32,所以Y的相对原子质量是16,则Y是O元素;焰色反应为黄色的元素为Na,则Z是Na元素;W元素基态原子的M层全充满,N层只有一个电子,则W的电子层排布是2、8、18、1,所以W为Cu元素。
(1)C元素位于元素周期表的第二周期IVA族;C元素组成的单质中,金刚石熔点很高,硬度很大,属于原子晶体;
(2)C与O元素中电负性较强的是O;二氧化碳是共价化合物,C与O原子之间形成2对共用电子对,所以电子式是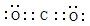 ;C=O中有1个
;C=O中有1个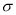 键和1个
键和1个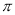 键,所以
键,所以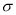 键和
键和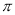 键的个数比是1:1;
键的个数比是1:1;
(3)过氧化钠属于离子化合物,含有离子键,且O与O原子之间是共价键,所以过氧化钠中既含离子键又含共价键;Cu的基态原子的核外电子排布式是[Ar]3d104s1;
(4)A是Cu单质,根据盖斯定律,将氧气与氢气消去,①+③+②/2,可得所求热化学方程式,所以A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式为Cu (s) + H2O2(l) + H2SO4(aq) = CuSO4(aq) + 2H2O (l)H =(64.4-285.8)kJ/mol-196.4/2kJ/mol=- 319.6 kJ / mol。
考点:考查元素的推断,盖斯定律的应用,化学用语的书写


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年河北省高三第五次调研考试化学试卷(解析版) 题型:实验题
(15分)为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验:

(1)F装置的烧杯中发生反应的离子方程式是 ;B装置中的现象是 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用O.36 mol· 的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
(已知 )
)
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.将铜屑加入氯化铁溶液中 2Fe3++Cu=2Fe2++ Cu2+
B.氢氧化镁与稀硫酸反应 H+ + OH— = H2O
C.向小苏打溶液中加入醋酸溶液 HCO3—+ H+ = CO2↑+ H2O
D.将铁粉加入稀硫酸中 2Fe + 6 H+ =2Fe3+ + 3H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省濉溪县高三第二次月考化学试卷(解析版) 题型:选择题
为实现下列实验目的,下表提供的主要玻璃仪器和所用试剂合理的是
选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
A | 鉴别Na2CO3和NaHCO3溶液 | 试管、胶头滴管 | 澄清石灰水 |
B | 分离I2和CCl4的混合物 | 分液漏斗、烧杯 | 乙醇 |
C | 实验室制取干燥的NH3 | 试管、酒精灯、带导管的橡皮塞 | NH4Cl、Ca(OH)2、碱石灰 |
D | 测定NaOH溶液的浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、酚酞试剂、0.1000 mol·L-1盐酸 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省濉溪县高三第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,17g甲基(14CH3)所含的中子数为9NA
B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO42- 数为0.2NA
C.0.1mol N2与足量的H2反应,转移的电子数为0.6NA
D.用惰性电极电解1L0.1mol·L-1 CuCl2溶液,当有0.3NA个电子通过时,可生成6.4g铜
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:选择题
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.PH大于7的溶液:Na+、Ba2+、SO32-、ClO—
B.含有0.1 mol·L-1 Fe(NO3)2的溶液:H+、Mg2+、SCN-、Cl-
C.使酚酞试液变红色的溶液:Na+、Ba2+、I-、Cl-
D.由水电离产生的c(H+)=10-13mol·L-1的溶液:NH4+、SO42-、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考理综化学试卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。

下列有关说法正确的是
A.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.步骤④的作用是达到富集溴的目的
C.过程②中MgCl2·6H2O加热脱水制得无水MgCl2
D.工业上电解熔融精盐的过程称为氯碱工业
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北大冶一中等六校高三元月调考理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑
B.Fe3O4与稀HNO3反应:Fe3O4+8H+===Fe2++2Fe3++4H2O
C.向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH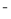 ===CaCO3↓+H2O
===CaCO3↓+H2O
D.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-===CO32-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com