
| A. | 离子半径:F->Mg2+>Al3+ | B. | 热稳定性:HCl>H2S>AsH3 | ||
| C. | 酸性:H3AlO3<H2CO3<H3PO4 | D. | 水溶性:SO2<H2S<NH3 |
分析 A.具有相同电子排布的离子中,原子序数大的离子半径小;
B.非金属性越强,对应氢化物越稳定;
C.非金属性越强,最高价氧化物的水化物酸性越强;
D.氨气含氢键极易溶于水,SO2与水反应,硫化氢可溶于水.
解答 解:A.具有相同电子排布的离子中,原子序数大的离子半径小,则离子半径:F->Mg2+>Al3+,故A正确;
B.非金属性越强,对应氢化物越稳定,则热稳定性:HCl>H2S>AsH3,故B正确;
C.非金属性越强,最高价氧化物的水化物酸性越强,则酸性:H3AlO3<H2CO3<H3PO4,故C正确;
D.氨气含氢键极易溶于水,SO2与水反应,硫化氢可溶于水,则水溶性:H2S<SO2<NH3,故D错误;
故选D.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:选择题
| A. |  从KI和I2的固体混合物中回收I2 | |
| B. |  除去乙醇中的苯酚 | |
| C. |  实验用CCl4提取溴水中的Br2 | |
| D. |  配制100mL 0.1000mol•L-1 K2Cr2O7溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: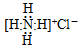 | |
| B. | 对硝基甲苯: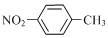 | |
| C. | 碳酸的电离方程式:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 硫离子的结构示意图: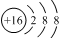 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
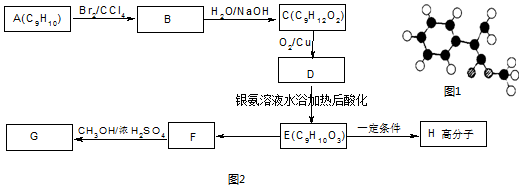
 ,G的一种同分异构体的结构简式为
,G的一种同分异构体的结构简式为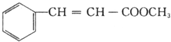 .
.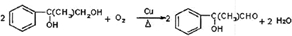
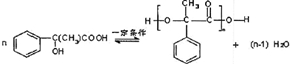 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.
如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 推论 |
| A | 乙烯气体可以使溴水褪色 | 乙烯发生取代反应 |
| B | 浓硫酸电导率比较低 | 硫酸浓度大时是弱电解质 |
| C | 氨气用于喷泉实验 | 氨气极易溶于水 |
| D | 硝酸溶液使pH试纸先变红后变白 | 硝酸酸性太强不能用pH试纸检测 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com