
| 选项 | 实验现象 | 推论 |
| A | 乙烯气体可以使溴水褪色 | 乙烯发生取代反应 |
| B | 浓硫酸电导率比较低 | 硫酸浓度大时是弱电解质 |
| C | 氨气用于喷泉实验 | 氨气极易溶于水 |
| D | 硝酸溶液使pH试纸先变红后变白 | 硝酸酸性太强不能用pH试纸检测 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙烯中含碳碳双键;
B.浓硫酸为粘稠液体,但硫酸为强电解质;
C.氨气分子间含氢键,极易溶于水;
D.浓硝酸具有强氧化性.
解答 解:A.乙烯中含碳碳双键,与溴水发生加成反应,使其褪色,故A错误;
B.浓硫酸为粘稠液体,不易电离,但硫酸为强电解质,混合物不是电解质也不是非电解质,故B错误;
C.氨气分子间含氢键,极易溶于水,可利用氨气的喷泉实验说明,故C正确;
D.浓硝酸具有强氧化性,则浓硝酸溶液使pH试纸先变红后变白,稀硝酸使pH试纸变红,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:NH4+、Cu2+、SO42-、Cl- | |
| B. | 含有大量Fe2+的溶液中:K+、Mg2+、C1O-、SO42- | |
| C. | 加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=l×10-12mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:F->Mg2+>Al3+ | B. | 热稳定性:HCl>H2S>AsH3 | ||
| C. | 酸性:H3AlO3<H2CO3<H3PO4 | D. | 水溶性:SO2<H2S<NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| C. | 实验中需用2.0 mol•L-1的Na2 CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950mL,201.4g | |
| D. | 减压过滤的原理是抽气泵给吸滤瓶减压,造成吸滤瓶内与布氏漏斗液面上的压力差,从而加快过滤速度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
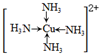
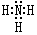 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.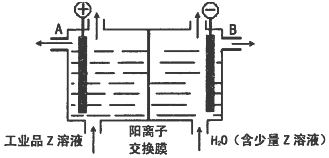
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、MnO2 | B. | C、FeS | C. | Si、FeO | D. | CuO、Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
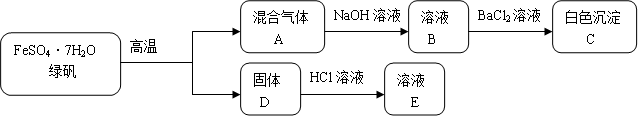
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+O2(g)?2SO3(g);△H=-2a KJ/mol | B. | 2SO2(g)+O2(g)2?SO3(g);△H=-a KJ/mol | ||
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=a KJ/mol | D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-2a KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com