
 某班学生利用0.100mol?L-1的盐酸和0.100mol?L-1NaOH溶液反应测定酸碱滴定曲线.甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示:下列说法错误的是( )
某班学生利用0.100mol?L-1的盐酸和0.100mol?L-1NaOH溶液反应测定酸碱滴定曲线.甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示:下列说法错误的是( )| A、甲组同学滴定时选用的滴定管为酸式滴定管 |
| B、乙和丙两组同学的操作上都存在着失误 |
| C、乙组同学操作上的不足之处是在滴定终点附近测试和记录pH的间隔太大 |
| D、造成丙组同学的曲线与甲组同学不同的原因可能是用待装液润洗锥形瓶 |


科目:高中化学 来源: 题型:
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A、乙的常见氧化物只有一种 |
| B、气态氢化物稳定性:丙>丁 |
| C、丙的氧化物能与戊的氢化物的水溶液反应 |
| D、原子半径大小:戊<丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S溶液中滴入酚酞呈现红色:S2-+2H2O?H2S+2OH- | ||||
B、用铜为电极电解饱和食盐水:2Cl-+2H2O
| ||||
| C、醋酸溶解含碳酸钙的水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||||
| D、小苏打溶液中加少量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | |
| C | D |
| A、原子半径:A>B |
| B、C的最简单氢化物的分子构型为平面三角形 |
| C、最高价氧化物对应水化物的酸性:D>C |
| D、SiO2可溶解在溶有HB的溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
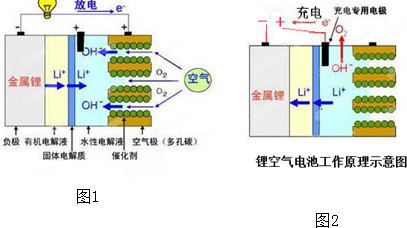
| A、锂空气电池配置了充电专用的阳极,可防止充电时空气极发生腐蚀和劣化.由于有固体电解质膜的存在,比普通锂电池更安全 |
| B、该电池放电时正极反应式为:O2+2H2O+4e-═4OH-.由于正极材料来源于空气,整个电池质量相同时,锂空气电池比普通锂电池能提供更多的电能 |
| C、锂空气电池电放完后也可以不必进行充电,只需要通过更换正极的水性电解液,并以合适的方式补给负极的金属锂,就可以连续使用 |
| D、在电池工作过程中,锂空气电池的空气极(多孔碳)附近电解液的pH逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电源左极为正极 |
| B、电解槽左侧的电极反应方程式为:2H2O-4e-═O2+4H+ |
| C、D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大 |
| D、在标准状况下,若1min后从C口处收集到的气体比B口处收集到的气体多2.24L,则有0.1NA个SO42-通过阴离子膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液化石油气的主要成分是甲烷 |
| B、不锈钢餐具和目前流通的硬币都属于合金 |
| C、医院给病人做X光透视时,常给病人服用“钡餐”,其主要成分是碳酸钡 |
| D、制作航天服的聚酯纤维和用于通讯光缆的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.| 1 |
| 2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com