
【题目】在下列物质中,金属镁不能燃烧的是
A. 二氧化碳 B. 氢气 C. 氧气 D. 氮气
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】SO2(g)+NO2(g)![]() SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。下列说法正确的是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。下列说法正确的是
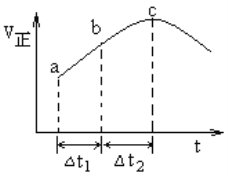
A. 反应物浓度:a点小于b点
B. 反应物的总能量大于生成物的总能量
C. △t1=△t2时,SO2的转化率:a~b段大于b~c段
D. 反应进行到c点达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分类是化学研究的重要方法之一。近年来发现,在金星大气层中存在三氧化二碳。下列物质与它属于同类的是
A.SO2、NO B.H2SO4、H2CO3
C.H2、O3 D.Na2SO3、KClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在通过反应Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O研究反应速率的影响因素后,对Na2S2O3产生了兴趣,查资料知Na2S2O3的名称为硫代硫酸钠,可视为一个S原子取代了Na2SO4中的一个O原子。该实验小组运用类比学习的思想预测了Na2S2O3的某些性质,并通过实验探究了自己的预测。
【提出假设】
(1)部分学生认为Na2S2O3与Na2SO4结构相似,化学性质也相似,因此室温时Na2S2O3溶液的pH____7(填“>”、“=”或“<”)。
(2)部分学生从S元素化合价推测Na2S2O3与Na2SO4性质相似,均具有较强的____。
【实验探究】取适量Na2S2O3晶体,溶于水中制成Na2S2O3溶液,进行如下探究(填写表中空格)。
实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
探究① | (3)____ | 溶液pH=8 | (4)____ |
探究② | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | (5)____ |
【实验结论】
(6)探究①__________。
(7)探究②__________。
【问题讨论】
(8)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由___________。
(9)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化。你的方案是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1molL﹣1 , c( Mg2+)=0.25molL﹣1 , c(Cl﹣)=0.2molL﹣1 , 则c(NO3﹣)为( )
A.0.15 molL﹣1
B.0.10 molL﹣1
C.0.25 molL﹣1
D.0.40 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于以下反应:A(s)+3B(g) ![]() 2C(g)+D(g),在一定温度、压强下,在体积可变的某容器中,当下列物理量不再发生变化时就可确定一定达到平衡状态的是
2C(g)+D(g),在一定温度、压强下,在体积可变的某容器中,当下列物理量不再发生变化时就可确定一定达到平衡状态的是
A. 混合气体的密度不随时间变化而变化 B. 3v正(B)=v逆(D)
C. 混合气体的压强保持不变 D. B、C、D的分子数之比为3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存且溶液为无色透明的一组离子的是
A.Cu2+、Na+、CO32-、SO42-
B.K+、Cl-、Na+、SO42-
C.Na+、NO3-、HCO3-、K+
D.Fe2+、MnO4-、Cl-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酶的叙述,正确的是
A. 酶的基本组成单位酸或脱氧核苷酸 B. 酶为反应过程供能从而降低反应活化能
C. 酶在活细胞以外不具有催化活性 D. 酶可以是其他酶促反应的的底物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现:一节电池烂在地里,能够使一平方米的土地失去利用价值。废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
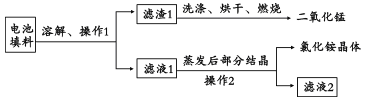
① 操作中先将电池填料研碎的目的是:________________。
② 操作l和操作2的名称都是___________,该操作中玻璃棒的作用是___________。
③ 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的化学方程式______________。与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
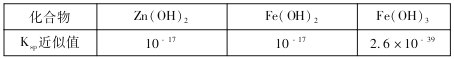
(3)用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。部分难溶的电解质溶度积常数(Ksp)如下表:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com