
【题目】一种高分子化合物(VI)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
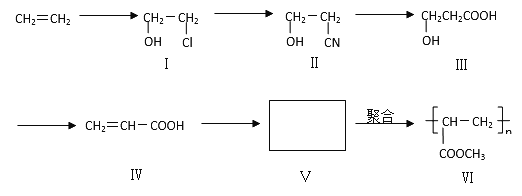
回答下列问题:
(1)目前工业上生产乙烯主要是以 为原料通过 反应来实现。
(2)化合物III生成化合物IV的另外一种产物是 。(提示:该反应的逆反应原子利用率为100%)
(3)写出合成路线中从化合物IV到化合物VI的两步反应的化学方程式: 、 。
(4)下列关于化合物III、IV和V的说法中,正确的是 (填字母)
A.化合物III可以发生氧化反应 |
B.化合物III不可以与NaOH 溶液反应 |
C.化合物IV能与氢气发生加成反应 |
D.化合物III、IV和V均可与金属钠反应生成氢气 |
E.化合物IV和V均可以使溴的四氯化碳溶液褪色
【答案】(1)石油;裂解;(2)水(每空1分);
(3)CH2=CH—COOH+CH3OH![]() CH2=CH—COOCH3+H2O (2分)
CH2=CH—COOCH3+H2O (2分)
n CH2=CH—COOCH3![]()
 (2分)
(2分)
(4)ACE (2分)。
【解析】试题分析:(1)目前工业上生产乙烯主要是以石油为原料通过裂解反应产生;(2)化合物III是HOCH2-CH2COOH,该物质发生消去反应生成化合物IV是CH2=CH-COOH和水,所以另外一种产物是水;(3)CH2=CH-COOH与甲醇发生酯化反应产生化合物V是CH2=CH-COOCH3,该物质含有碳碳双键,发生加聚反应,产生聚丙烯酸甲酯 ;从化合物IV到化合物VI的两步反应的化学方程式是CH2=CH—COOH+CH3OH
;从化合物IV到化合物VI的两步反应的化学方程式是CH2=CH—COOH+CH3OH![]() CH2=CH—COOCH3+H2O;n CH2=CH—COOCH3
CH2=CH—COOCH3+H2O;n CH2=CH—COOCH3![]()
 ;(4)A.化合物III含有醇羟基,可以被氧化发生氧化反应,正确;B.化合物III含有羧基,可以与NaOH 溶液反应,错误;C.化合物IV含有碳碳双键,能与氢气发生加成反应产生CH3CH2COOH,正确;D.化合物III含有醇羟基和羧基,化合物IV含有羧基都可以与金属钠发生反应产生氢气,而化合物V含有酯基,,不可与金属钠反应生成氢气,错误;E.化合物IV和V均含有碳碳双键,所以都可以使溴的四氯化碳溶液褪色,正确。
;(4)A.化合物III含有醇羟基,可以被氧化发生氧化反应,正确;B.化合物III含有羧基,可以与NaOH 溶液反应,错误;C.化合物IV含有碳碳双键,能与氢气发生加成反应产生CH3CH2COOH,正确;D.化合物III含有醇羟基和羧基,化合物IV含有羧基都可以与金属钠发生反应产生氢气,而化合物V含有酯基,,不可与金属钠反应生成氢气,错误;E.化合物IV和V均含有碳碳双键,所以都可以使溴的四氯化碳溶液褪色,正确。


科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电后,发现左侧溶液变蓝色,一段时间后,蓝色又逐渐变浅。(已知:3I2+ 6OH—= IO3—+5I—+3H2O , IO3—离子无色);下列说法不正确的是

A.右侧发生的电极反应式:2H2O+2e—= H2↑+2OH-
B.a为电源正极
C.电解结束时,右侧溶液中没有IO3—
D.用阴离子交换膜,电解槽内发生的总化学方程式为:KI + 3H2O ![]() KIO3+3H2↑
KIO3+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.常温下,1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0
D.常温下,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关油脂的叙述中,不正确的
A. 天然油脂没有固定的熔点和沸点,所以油脂是混合物 B. 油脂是酯的一种
C. 油脂是由高级脂肪酸和甘油所生成的酯 D. 油脂都不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产、环境等社会实际密切相关.下列叙述正确的是( )
A.铝热反应是炼铁最常用的方法
B.硅是现代光学及光纤制品的基本原料
C.采用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法可提高空气质量
D.袋装食品常用生石灰包作为食品的抗氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中可能含有H+、NH![]() 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO![]() 、SO
、SO![]() 、NO
、NO![]() 中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( )
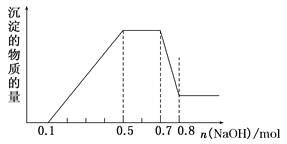
A. 溶液中一定不含CO![]() ,可能含有SO
,可能含有SO![]() 和NO
和NO![]()
B. 在滴加NaOH溶液物质的量为0.5~0.7 mol时,发生的离子反应为:Al3++4OH-===AlO![]() +2H2O
+2H2O
C. 溶液中的阳离子只有H+、Mg2+、Al3+
D. n(H+)∶n(NH![]() )∶n(Mg2+)=2∶4∶1
)∶n(Mg2+)=2∶4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g。

(1)电源电极X的名称为________。
(2)pH变化:A_______,B_______,C_______。(填“增大”“减小”或“不变”)
(3)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为______________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液的pH为_______(设电解前后溶液体积无变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:
2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同;据此回答:

(1)a电极的电极材料是 (填“PbO2”或“Pb”)。
(2)丙装置中发生电解的总反应方程式为 。
(3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量是 。
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为 极,d电极上发生反应的电极反应式为 。
(5)电解后取a mL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入b mL CH3COOH溶液时,混合溶液的pH恰好等于7(体积变化忽略不计)。已知CH3COOH的电离平衡常数为1.75×10-5,则a/b = 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com