
【题目】科学家发现一种新型分子,其化学式为H3。相同条件下,等质量的H3和H2具有相同的
A. 原子数 B. 分子数 C. 体积 D. 物质的量
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】G是一种新型香料的主要成分之一,其结构中含有三个六元环.G的合成路线如图(部分产物和部分反应条件略去): 
己知:①RCH=CH2+CH2=CHR﹣﹣﹣﹣CH2═CH2+RCH═CHR;
②B的核磁共振氢谱图显示分子中有6 种不同环境的氢原子;
③D和F互为同系物.
(1)(CH3)2C=CH2 , 分子中在同一平面内的原子数最多为 . D分子中含有的含氧官能团名称是 .
(2)A→R反应过程中涉及的反应类型依次为、 .
(3)E的结构简式为 . G的结构简式为 .
(4)B→C的化学方程式为 .
(5)写出同时满足下列条件的F的一种同分异构体的结构简式 . ①能与FeCl3溶液发生显色反应;
②苯环上有两个取代基且能发生水解反应;
③其核磁共振氢谱图中有4 组峰.
(6)模仿由苯乙烯合成F的方法,写出由丙烯制取  的合成路线: .
的合成路线: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物J是在医疗上有重要的应用,分子结构中含有3个六元环.其中一种合成路线如图: 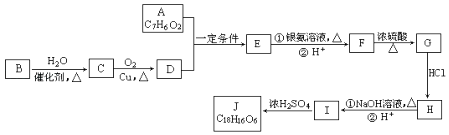
已知:
①A既能发生银镜反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4个吸收峰,且峰面积之比为1:2:2:1.
②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平.
③R1﹣CHO+R2﹣CH2﹣CHO ![]()
![]()
请回答下列问题:
(1)E的结构简式是 , G中含氧官能团的名称 .
(2)写出有机反应类型H→I , F→G .
(3)写出I生成J的化学方程式 .
(4)A的含苯环同分异构体有种,写出其中符合以下要求的同分异构体的结构简式 . ①能发生银镜反应 ②能发生水解反应 ③含有苯环
(5)写出用B合成 ![]() 的路线图(提示:路线图的书写方法RCH=CH2
的路线图(提示:路线图的书写方法RCH=CH2![]()
![]()
![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的饱和NaOH溶液中加入少量Na2O2固体,恢复到原温度时,下列说法正确的是
A. 溶液中的Na+增多 B. 溶液的碱性增强
C. 溶质的质量分数不变 D. 溶液的质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4﹣、C2O42﹣三者中所占物质的量分数〔分布系数)随pH变化的关系如图所示.下列表述不正确的是( ) 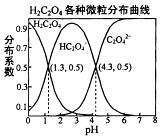
A.HC2O4﹣H++C2O42﹣ , K=1×10﹣4.3
B.将等物质的量的NaHC2O4、NAa2C2O4溶于水中,所得溶液PH恰好为4.3
C.常温下HF的KB=1×10﹣﹣3.45 , 将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F﹣=HF+HC2O4﹣
D.在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将10mL pH=1的CH3COOH溶液加水稀释至100mL后,溶液中的pH值为( )
A.2
B.2<pH<7
C.1<pH<2
D.无法判读
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol FeS与b mol FeO投入到VL cmol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
① (3a+3b)mol ②[Vc-(9a+b)/3]mol ③ Vc-(a+b)/3 mol ④(a+b)×189g
A. ①②④ B. ①② C. ②④ D. ②③④
【答案】A
【解析】反应物中的铁元素转化为Fe(NO3)3,则反应中未被还原的硝酸可能为①(3a+3b)mol或④(a+b)×189g,amolFeS与bmolFeO转化为Fe(NO3)3、H2SO4,失去电子(9a+b)mol,根据得失电子数目相等可知产生NO(9a+b)/3mol,则反应中未被还原的硝酸可能为②[Vc-(9a+b)/3]mol,总之,反应中未被还原的硝酸可能为①②④,故选A。
【题型】单选题
【结束】
25
【题目】(1)在反应式:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O中,若b=1,d=3,则X的分子式为____________。
(2)完成以下氧化还原反应的离子反应方程式,并标出电子转移的方向和数目:___________
___CrI3+____Cl2+______——____K2CrO4+____KIO4+___KCl+______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg—Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。回答下列问题。

(1)原Mg-Al合金的质量是_________,合金中Mg与Al的物质的量之比是________;
(2)所加NaOH溶液的物质的量浓度是________________;
(3)原HCl溶液的物质的量浓度是_____________________。
(4)向含有0.1molNH4Al(SO4)2的溶液中逐滴加入5mol·L-1NaOH溶液,开始发现熔液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体(NH3)逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com