
【题目】将一定质量的Mg—Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。回答下列问题。

(1)原Mg-Al合金的质量是_________,合金中Mg与Al的物质的量之比是________;
(2)所加NaOH溶液的物质的量浓度是________________;
(3)原HCl溶液的物质的量浓度是_____________________。
(4)向含有0.1molNH4Al(SO4)2的溶液中逐滴加入5mol·L-1NaOH溶液,开始发现熔液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体(NH3)逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。________

【答案】 5.1 g 1∶1 6 mol·L1 5 mol·L1 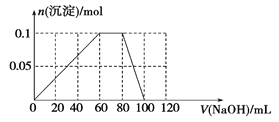
【解析】分析图象可知,Mg—Al合金与HCl反应时,盐酸过量,图象中各线段对应的化学反应如下:OA段:①H++OH-=H2O,AB段:②Mg2++2OH-=Mg(OH)2↓和③Al3++3OH-=Al(OH)3↓,BC段:④Al(OH)3+OH-=AlO2-+2H2O。据此解析如下:
(1) B点对应的沉淀为Al(OH)3和Mg (OH)2,其总质量为13.6g,C点对应的沉淀为Mg (OH)2,其质量为5.8g,所以n[Mg (OH)2]= n(Mg)=0.1mol,即金属镁的质量为2.4g;则
n(Al)= n[Al(OH)3]= ![]() =0.1mol,则金属铝的质量为2.7g,所以合金中Mg与Al的物质的量之比为1∶1,合金的总质量为5.1g。
=0.1mol,则金属铝的质量为2.7g,所以合金中Mg与Al的物质的量之比为1∶1,合金的总质量为5.1g。
(2) 由(1)的分析可知 n[Al(OH)3] =0.1mol,则反应④中溶解Al(OH)3沉淀需要n(NaOH)= 0.1mol,BC段加入氢氧化钠溶液的体积为20mL,所以c(NaOH)= ![]() = 5mol/L。
= 5mol/L。
(3)当加入NaOH溶液的体积为120mL时,即B点的溶液中溶质只有NaCl,根据其组成比即n(Na+)=n(Cl-),可得n(NaOH)=n(HCl)=0.12L×5mol/L=0.60mol,所以c(HCl)= ![]() =
=
6mol/L。
(4)据题意,加入NaOH溶液时,先与Al3+反应,再与NH4+反应,最后Al(OH)3溶解,反应的离子方程式依次为①Al3++3OH-=Al(OH)3↓,②NH4++OH-=NH3+H2O,③Al(OH)3+OH-=AlO2-+2H2O,由NH4Al(SO4)2的物质的量为0.1mol和c(NaOH)= 5mol/L,求出反应①中生成n[Al(OH)3] =0.1mol,消耗V(NaOH)=60mL,反应②消耗V(NaOH)=20mL,反应③消耗V(NaOH)=20mL,由此可画出图象如答案所示。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】已知下列反应的反应热:
①CH3COOH(l)+2O2(g)=2CO2 (g)+2H2O(l)△H=﹣870.3kJ∕mol
②C(S)+O2(g)=CO2 (g)△H=﹣393.5kJ∕mol
③2C(S)+2H2(g)+O2(g)=CH3COOH(l)△H=﹣488.3kJ∕mol
请写出H2燃烧热的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气的集气瓶中,充分燃烧后发现瓶壁上有黑色固体附着,下面是该兴趣小组的几点推测,你认为不合理的是( )
A. 黑色固体是碳
B. 钠在燃烧时只发生了一个反应
C. 钠在金属活动性顺序中排在镁前面,所以钠能与二氧化碳反应(已知:2Mg+CO2![]() 2MgO+C)
2MgO+C)
D. 钠保存在煤油中,可能滤纸没有完全吸干煤油,煤油不完全燃烧产生碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1molCH3OH(甲醇)和1molH2混合气体和足量的氧气燃烧后,在150℃时 将混合气体通过足量的Na2O2后,Na2O2增重的质量为
A. 15g B. 34g C. 60g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:
(1)Se是S的下一周期同主族元素,其核外电子排布式为;
(2)第一电离能:S(填“>”“<”或“=”,下同)P;电负性:SP.
(3)三硫化四磷分子中P原子采取杂化,与PO3﹣互为等电子体的化合物分子的化学式为 .
(4)二硫化碳属于(填“极性”或“非极性”)分子.
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为 .
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是 .
(7)氢氧化钠具有NaCl型结构,其晶饱中Na+与OH﹣之间的距离为acm,晶胞中Na+的配位数为 , 用NA表示阿伏加德罗常数的数值,NaOH的密度为 gcm﹣3 . 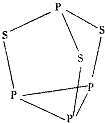
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等.用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如图1: 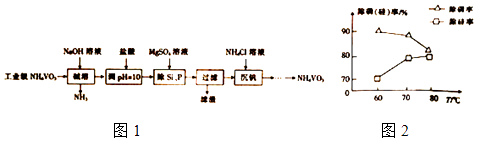
(1)碱溶时,下列措施有利于NH3逸出的是(填字母). a、升高温度 b、增大压吸 c、增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3 , 已知Ksp(MgSiO3)=2.4×l0﹣5 . 若滤液中c(SiO32﹣)=0.08mol/L,则c(Mg2+)= ②由图2可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和;但随着温度的升高,除硅率升高,其原因是(用离子方程式表示).
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率.加入蒸馏水的目的是
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素为无色、细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等,最终导致死亡。该外毒素为环状肽,结构式如图所示。

请据图分析回答下面的问题。
(1)该化合物中含有________个游离的氨基,________个游离的羧基。
(2)组成该化合物的氨基酸有_______种,其中重复出现的R基是_______________,请写出氨基酸的结构通式:____________________________。
(3)该化合物含有________个肽键。
(4)b框所示的R基所构成的氨基酸的相对分子质量是________。
(5)该外毒素在环状肽形成过程中失去了________个水分子,相对分子质量减少了________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是

A.上述反应是置换反应
B.上述反应是放热反应
C.加热且无水条件下,Na可以与CuSO4反应并生成Cu
D.上述反应中CuSO4表现了还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com