
【题目】三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:
(1)Se是S的下一周期同主族元素,其核外电子排布式为;
(2)第一电离能:S(填“>”“<”或“=”,下同)P;电负性:SP.
(3)三硫化四磷分子中P原子采取杂化,与PO3﹣互为等电子体的化合物分子的化学式为 .
(4)二硫化碳属于(填“极性”或“非极性”)分子.
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为 .
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是 .
(7)氢氧化钠具有NaCl型结构,其晶饱中Na+与OH﹣之间的距离为acm,晶胞中Na+的配位数为 , 用NA表示阿伏加德罗常数的数值,NaOH的密度为 gcm﹣3 . 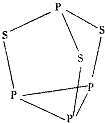
【答案】
(1)[Ar]3d104s24p4
(2)<;>
(3)sp3;SO3
(4)非极性
(5)NA
(6)HN3分子间存在氢键
(7)6;![]()
【解析】解:(1)Se是S的下一周期同主族元素,其核外电子排布式为[Ar]3d104s24p4 , 所以答案是:[Ar]3d104s24p4;(2)同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于相邻元素;同一主族元素中,元素的第一电离能随着原子序数的增大而减小;同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,第一电离能:S<P;电负性:S>P,所以答案是:<;>;(3)P4S3中P原子成3个P﹣S键、含有一对孤对电子,杂化轨道数为4,P原子采取sp3杂化;与PO3﹣互为等电子体的化合物分子的化学式为SO3; 所以答案是:sp3;SO3;(4)二硫化碳与二氧化碳的结构相似,正负电荷中心重合,属于非极性分子,所以答案是:非极性;(5)根据图知,每个P上1对孤对电子对,每个S有2对孤对电子对,1mol共10对孤对电子对,0.1mol含有NA孤对电子对数,所以答案是:NA;(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是HN3分子间存在氢键,使沸点反常的升高,所以答案是:HN3分子间存在氢键;(7)以体心Na+研究,与之相邻的Cl﹣位于面心,晶胞中Na+的配位数为6,晶胞中Na+与Cl﹣之间的距离为a cm,则晶胞棱长为2a cm,晶胞体积为(2a cm)3 , 晶胞中Na+离子数目为1+12× ![]() =4、Cl﹣离子数目为8×
=4、Cl﹣离子数目为8× ![]() +6×
+6× ![]() =4,则晶胞质量为4×
=4,则晶胞质量为4× ![]() g,则晶胞密度为4×
g,则晶胞密度为4× ![]() g÷(2a cm)3=
g÷(2a cm)3= ![]() g.cm﹣3 ,
g.cm﹣3 ,
所以答案是:6; ![]() .
.


 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4﹣、C2O42﹣三者中所占物质的量分数〔分布系数)随pH变化的关系如图所示.下列表述不正确的是( ) 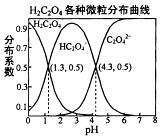
A.HC2O4﹣H++C2O42﹣ , K=1×10﹣4.3
B.将等物质的量的NaHC2O4、NAa2C2O4溶于水中,所得溶液PH恰好为4.3
C.常温下HF的KB=1×10﹣﹣3.45 , 将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F﹣=HF+HC2O4﹣
D.在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:_____________________ 。
(2)铝还用于冶炼熔点较高的金属如钒、铬、锰等,请配平下列用铝冶炼金属钒的化学反应方程式:_____ V2O5 + Al ![]() Al2O3 + V。该反应中氧化剂是__________________ ,要得到1mol金属钒,需要纯铝的质量__________g。
Al2O3 + V。该反应中氧化剂是__________________ ,要得到1mol金属钒,需要纯铝的质量__________g。
(3)铝与NaOH溶液反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 蛋白质都是由C、H、N、O四种元素组成的
B. 天然蛋白质水解的最终产物均为α氨基酸
C. 强酸、强碱和重金属盐都可使蛋白质变性
D. 构成蛋白质的某些氨基酸人体自身是不能合成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg—Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。回答下列问题。

(1)原Mg-Al合金的质量是_________,合金中Mg与Al的物质的量之比是________;
(2)所加NaOH溶液的物质的量浓度是________________;
(3)原HCl溶液的物质的量浓度是_____________________。
(4)向含有0.1molNH4Al(SO4)2的溶液中逐滴加入5mol·L-1NaOH溶液,开始发现熔液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体(NH3)逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关摩尔质量的说法,正确的是
A. CO2的摩尔质量等于它的相对分子质量
B. H2的摩尔质量,等于6.02×1023个氢气分子的质量
C. H2O的摩尔质量为18g
D. Al(OH)3与Na2O2的摩尔质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,c(H+)最大的是( )
A. 0.1 mol/L HCl溶液 B. 0.1 mol/L NaOH溶液
C. 0.1 mol/L H2SO4溶液 D. 0.1 mol/L CH3COOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质世界丰富多彩,可以分类认识和研究。下列依据不同角度对物质分类正确的是
A.金属单质在化学反应中化合价升高,是氧化剂
B.Na2O、CaO与酸反应只生成盐和水,均属于碱性氧化物
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.盐酸和熔融的烧碱均能导电,都是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com