
【题目】下列溶液中,c(H+)最大的是( )
A. 0.1 mol/L HCl溶液 B. 0.1 mol/L NaOH溶液
C. 0.1 mol/L H2SO4溶液 D. 0.1 mol/L CH3COOH溶液
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道稀硫酸中的哪种粒子(H2O、H+、SO![]() )能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
)能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。

(1)通过实验Ⅰ可以证明____________________________________。
(2)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入________,再加入________。
(3)探究结果为_____________________________________________。
(4)反应的离子方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂.在沸腾的NaOH稀溶液中会迅速水解.回答下列问题:
(1)Se是S的下一周期同主族元素,其核外电子排布式为;
(2)第一电离能:S(填“>”“<”或“=”,下同)P;电负性:SP.
(3)三硫化四磷分子中P原子采取杂化,与PO3﹣互为等电子体的化合物分子的化学式为 .
(4)二硫化碳属于(填“极性”或“非极性”)分子.
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为 .
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是 .
(7)氢氧化钠具有NaCl型结构,其晶饱中Na+与OH﹣之间的距离为acm,晶胞中Na+的配位数为 , 用NA表示阿伏加德罗常数的数值,NaOH的密度为 gcm﹣3 . 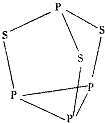
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如下图所示,其中A为澄清溶液,C为难溶于水的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。

请回答下列问题:
(1)写出化学式:A________。
(2)写出下列反应的离子方程式:
A→B___________________________________。
B→D_________________________________。
C→E_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素为无色、细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等,最终导致死亡。该外毒素为环状肽,结构式如图所示。

请据图分析回答下面的问题。
(1)该化合物中含有________个游离的氨基,________个游离的羧基。
(2)组成该化合物的氨基酸有_______种,其中重复出现的R基是_______________,请写出氨基酸的结构通式:____________________________。
(3)该化合物含有________个肽键。
(4)b框所示的R基所构成的氨基酸的相对分子质量是________。
(5)该外毒素在环状肽形成过程中失去了________个水分子,相对分子质量减少了________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酯说法正确的是( )
A. 同乙醇、乙醛等含氧有机物类似,乙酸乙酯也能溶于水
B. 乙酸乙酯在碱性条件下的水解反应可被称为皂化反应
C. 制取乙酸乙酯时,适当增大乙醇的浓度,可使乙酸完全反应
D. 检查油脂皂化反应是否完全的方法是用玻璃棒蘸取反应液,滴入装有热水的试管中,振荡,看有无油滴浮在水面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72﹣(橙色)+H2O2CrO42﹣(黄色)+2H+ . 用K2Cr2O7溶液进行下列实验: 
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72﹣被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空 
(1)根据图1请写出合成氨的热化学方程式(热量用E1、E2或E3表示).
(2)实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(Ls)]与反应时间t(s)的关系如图2所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O,回答如下问题:
①0→t2时间段内反应速率增大的原因是: ,
②t2→t时间段内反应速率减小的原因是: ,
③图中阴影部分“面积”表示t1→t3时间里 .
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42﹣物质的量浓度 D.MnO4﹣物质的量浓度的减小.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学实验小组将6mol A和 8mol B 充入2L的密闭容器中,某温度下,发生的反应为A(g)+3B(g)C(g)+D(g)△H=﹣49.0 kJmol﹣1 . 测得B的物质的量随时间变化的关系如图所示(实线). 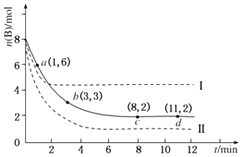
(1)下列时间段A的平均反应速率最大的是(填选项字母,下同),最小的是 .
A.0~1min B.1~3min C.3~8min D.8~11min
(2)b点的正反应速率(填“大于”“等于”或“小于”)逆反应速率.
(3)平衡时B的转化率为 , 该温度下的化学平衡常数K= .
(4)仅改变某一实验条件再进行两次实验,测得B的物质的量随时间变化如图中虚线所示.则曲线Ⅰ改变的条件是 , 曲线Ⅱ改变的条件是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com