
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等.用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如图1: 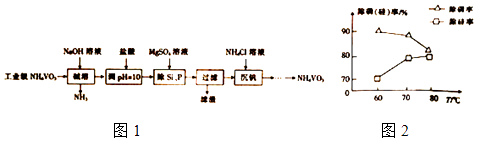
(1)碱溶时,下列措施有利于NH3逸出的是(填字母). a、升高温度 b、增大压吸 c、增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3 , 已知Ksp(MgSiO3)=2.4×l0﹣5 . 若滤液中c(SiO32﹣)=0.08mol/L,则c(Mg2+)= ②由图2可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和;但随着温度的升高,除硅率升高,其原因是(用离子方程式表示).
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率.加入蒸馏水的目的是
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为 .
【答案】
(1)ac
(2)3×10﹣4mol/L;升温促进Mg2+水解生成Mg(OH)2;SiO32﹣+2H2O ![]() H2SiO3↓+2OH﹣(或者SiO32﹣+3H2O
H2SiO3↓+2OH﹣(或者SiO32﹣+3H2O ![]() H4SiO4↓+2OH﹣)
H4SiO4↓+2OH﹣)
(3)水浴加热
(4)9;使两份溶液总体积相等,便于比较
(5)2NH4VO3+4H2C2O4=(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O
【解析】解:(1)根据气体在水中溶解度的影响因素可知,升温、减压都可以减小气体的溶解度,故选a,由于氨气在水中形成氨水能电离出氢氧根离子,根平衡移动原理,增加氢氧根浓度可以减小氨气 的溶解度,故选c, 所以答案是:ac;(2)①已知Ksp(MgSiO3)=c(Mg2+)c(SiO32﹣)=2.4×l0﹣5 , 结合c(SiO32﹣)=0.08mol/L,则c(Mg2+)= ![]() =3×10﹣4mol/L,
=3×10﹣4mol/L,
所以答案是:3×10﹣4mol/L;②根据影响盐类水解的因素可知,升高温度水解程度增大,镁离子、硅酸根离子都是易水解的离子,所以升温促进Mg2+水解生成Mg(OH)2 , 使硅酸根水解生成硅沉淀,反应的离子方程式为SiO32﹣+2H2O ![]() H2SiO3↓+2OH﹣(或者SiO32﹣+3H2O
H2SiO3↓+2OH﹣(或者SiO32﹣+3H2O ![]() H4SiO4↓+2OH﹣);
H4SiO4↓+2OH﹣);
所以答案是:升温促进Mg2+水解生成Mg(OH)2;SiO32﹣+2H2O ![]() H2SiO3↓+2OH﹣(或者SiO32﹣+3H2O
H2SiO3↓+2OH﹣(或者SiO32﹣+3H2O ![]() H4SiO4↓+2OH﹣);(3)沉钒时,反应温度需控制在50℃,可采用水浴加热,
H4SiO4↓+2OH﹣);(3)沉钒时,反应温度需控制在50℃,可采用水浴加热,
所以答案是:水浴加热;(4)探究NH4Cl的浓度对沉钒率的影响,为要有可比性,两溶液的体积必须相等,所以要 向A中加入约9 mL蒸馏水,使两份溶液总体积相等,便于比较;
所以答案是:9;使两份溶液总体积相等,便于比较;(5)偏钒酸铵与草酸反应生成(NH4)2[(VO)2(C2O4)3],V元素化合价降低,则碳元素化合价升高由二氧化碳生成,则化学方程为:2NH4VO3+4H2C2O4=(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O;
所以答案是:2NH4VO3+4H2C2O4=(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】常温下,将10mL pH=1的CH3COOH溶液加水稀释至100mL后,溶液中的pH值为( )
A.2
B.2<pH<7
C.1<pH<2
D.无法判读
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
①标准状况下,1LHCl和1LH2O的物质的量相同;
②标准状况下,11.2 LH2和14gN2所含原子数相同;
③28gCO 的体积约为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积相同;
⑤同温同体积时,气体物质的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
A. ⑤⑥ B. ②③⑤⑥ C. ②⑤⑥ D. ①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg—Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图所示。回答下列问题。

(1)原Mg-Al合金的质量是_________,合金中Mg与Al的物质的量之比是________;
(2)所加NaOH溶液的物质的量浓度是________________;
(3)原HCl溶液的物质的量浓度是_____________________。
(4)向含有0.1molNH4Al(SO4)2的溶液中逐滴加入5mol·L-1NaOH溶液,开始发现熔液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体(NH3)逸出;最后白色沉淀逐渐减少并最终消失。请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)→2NH3(g)+CO2(g).判断该分解反应已经达到化学平衡的是( )
A.密闭容器中混合气体的密度不变
B.密闭容器中c(NH3):c(CO2)=2:1
C.2v(NH3)=v(CO2)
D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。下列判断正确的是( )

A. 原NaOH溶液的浓度为0.2 mol·L-1
B. 通入CO2在标准状况下的体积为448 mL
C. 所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体,再在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①Ⅰ图对应溶液中的溶质为NaHCO3
②Ⅱ图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1∶1
③Ⅲ图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1∶1
④Ⅳ图对应溶液中的溶质为Na2CO3
A. ①② B. ①③
C. ②④ D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com