
【题目】向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体,再在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①Ⅰ图对应溶液中的溶质为NaHCO3
②Ⅱ图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1∶1
③Ⅲ图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1∶1
④Ⅳ图对应溶液中的溶质为Na2CO3
A. ①② B. ①③
C. ②④ D. ②③
【答案】A
【解析】向一定量NaOH溶液的烧杯中通入不同量的CO2气体,当二氧化碳少量时,产物是NaOH和Na2CO3的混合物,当NaOH和CO2恰好完全反应时,产物只有Na2CO3,当二氧化碳过量时,产物可能只有NaHCO3,也可能是Na2CO3和NaHCO3的混合物.Ⅰ、图中刚开始加入HCl就产生了二氧化碳,因此溶质只能是NaHCO3,故①正确;Ⅱ、从图中看出刚滴下去盐酸一个单位后产生了二氧化碳,说明此时碳酸根的量是一个单位(盐多酸少,碳酸钠和盐酸一比一反应生成碳酸氢钠),后来盐酸加了两个单位才把所有二氧化碳反应出来,说明溶液中总的碳酸氢根量为两个单位,但有一个单位的是之前碳酸根得来的,所以原溶液中碳酸根的量和碳酸氢根的量相等,即c(Na2CO3)=c(NaHCO3),故②正确;Ⅲ、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,且产生二氧化碳所消耗的盐酸也是两个单位,说明产物只有Na2CO3,物料守恒可知:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);故③错误;Ⅳ、从图中看出,滴入了两个单位的盐酸后才开始产生气泡,说明产物是NaOH和Na2CO3的混合物,一个单位的盐酸和NaOH反应,第二个单位的盐酸和Na2CO3反应生成NaHCO3,后由图中可看出,NaHCO3又消耗了一个单位的盐酸,则含有氢氧化钠和碳酸钠的量之比是1:1,故④错误.由上分析知①②正确,③④错误,故选A。


科目:高中化学 来源: 题型:
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等.用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如图1: 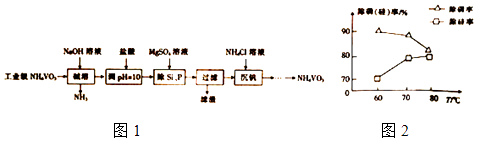
(1)碱溶时,下列措施有利于NH3逸出的是(填字母). a、升高温度 b、增大压吸 c、增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3 , 已知Ksp(MgSiO3)=2.4×l0﹣5 . 若滤液中c(SiO32﹣)=0.08mol/L,则c(Mg2+)= ②由图2可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和;但随着温度的升高,除硅率升高,其原因是(用离子方程式表示).
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率.加入蒸馏水的目的是
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛:CH3OH(g)HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1L的密闭容器中进行、甲醇的物质的量为1mol).下列有关说法中正确的是( ) 
A.脱氢反应的△H<0
B.600 K时,Y点甲醇的v(逆)<v(正)
C.从Y点到Z点可通过增大压强
D.在t1K时,该反应的平衡常数为8.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是

A.上述反应是置换反应
B.上述反应是放热反应
C.加热且无水条件下,Na可以与CuSO4反应并生成Cu
D.上述反应中CuSO4表现了还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法:2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法II和方法III制取Cu2O而很少用方法I,其原因是 .
(2)己知:2Cu(s)+ ![]() O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+
O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+ ![]() O2(g)=CO(s)△H=﹣bkJmol﹣1
O2(g)=CO(s)△H=﹣bkJmol﹣1
Cu(s)+ ![]() O2(g)=CuO(s)△H=﹣ckJmol﹣1
O2(g)=CuO(s)△H=﹣ckJmol﹣1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=kJmol﹣1 .
(3)方法II采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 .
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2 . 该制法的化学方程式为 .
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: 2H2O(g) ![]() 2H2(g)+O2(g)△H>0
2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是(填字母代号).
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10﹣5mol/(Lmin)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10﹣10 , 则此时溶液中的c(Ag+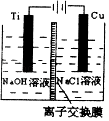
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO(g)+Cl2(g)2ClNO(g)△H<0
写出该反应的平衡常数表达式 .
为研究不同条件对反应的影响,:在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应达到平衡.测得10min内v(ClNO)=7.5×10﹣3 molL﹣1min﹣1 , 则平衡后n(Cl2)=mol,NO的转化率α1= . 其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”),平衡常数K(填“增大”“减小”或“不变”).若要使K减小,可采取的措施是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物与生产、生活关系密切.t℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25,反应达到平衡时n(CO):n(CO2)= . 若在1L密闭容器中加入0.02mol FeO(s),并通入xmolCO,t℃时反应达到平衡.此时FeO(s)转化率为50%,则x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( ) 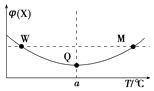
A.升高温度,平衡常数减小
B.W,M两点Y的正反应速率相等
C.平衡后充入Z达到新平衡时Z的体积分数增大
D.M点时,Y的转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由以下一些微粒:136C、3919K、4020Ca、126C、147N、4018Ar。其中:
(1)互为同位素的是________和________;
(2)中子数相等,但质子数不相等的是______和______、______和______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com