
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)→2NH3(g)+CO2(g).判断该分解反应已经达到化学平衡的是( )
A.密闭容器中混合气体的密度不变
B.密闭容器中c(NH3):c(CO2)=2:1
C.2v(NH3)=v(CO2)
D.密闭容器中氨气的体积分数不变
【答案】A
【解析】解:NH2COONH4(s)→2NH3(g)+CO2(g).
A.密度= ![]() ,总质量会变,体积不变,故密闭容器中混合气体的密度不变可作为判断是否达到化学平衡状态的依据,故A正确;
,总质量会变,体积不变,故密闭容器中混合气体的密度不变可作为判断是否达到化学平衡状态的依据,故A正确;
B.氨气和二氧化碳的化学计量数之比为2:1,故密闭容器中c(NH3):c(CO2)=2:1不能作为判断是否达到化学平衡状态的依据,故B错误;
C.未能体现正逆反应,故2v(NH3)=v(CO2)不能作为判断是否达到化学平衡状态的依据,故C错误;
D.氨气和二氧化碳的化学计量数之比为2:1,故密闭容器中氨气的体积分数始终保持不变,故不能作为判断是否达到化学平衡状态的依据,故D错误;
故选A.
【考点精析】本题主要考查了化学平衡状态的判断的相关知识点,需要掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能正确解答此题.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】下列关于电离常数的说法正确的是( )
A.电离常数随着弱电解质的浓度增大而增大
B.CH3COOH的电离常数表达式为Ka= ![]()
C.CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小
D.电离常数只与温度有关,与浓度无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka(CH3COOH)=Kb(NH3H2O)=1.75×10﹣5 , 下列说法正确的是( )
A.用0.1molL﹣1的盐酸滴定0.1molL﹣1的氨水时,可用酚酞作指示剂
B.0.2 molL﹣1的醋酸与0.1 molL﹣1的氢氧化钠溶液等体积混合,所得溶液中:c(CH3COO﹣)+c(OH﹣)=C(CH3COOH)+C(H+)
C.pH=3的醋酸与pH=11的氨水等体积混合,所得溶液中有水电离出的C(H+)=1×10﹣7 molL﹣1
D.pH=3的盐酸与pH=11的氨水等体积混合,所得溶液中C(NH3H2O)>C(NH4+)>C(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1molCH3OH(甲醇)和1molH2混合气体和足量的氧气燃烧后,在150℃时 将混合气体通过足量的Na2O2后,Na2O2增重的质量为
A. 15g B. 34g C. 60g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在课堂上,老师演示了金属钠与CuSO4溶液的反应,同学们观察到该反应中生成了蓝色的Cu(OH)2沉淀而没有发现铜单质生成。但某同学想:会不会因生成的铜较少被蓝色沉淀所覆盖而没有被发现呢?于是他想课后到实验室继续探究,希望进一步用实验来验证自己的猜测是否正确。
假如该同学是你,请你写一张实验准备单交给老师,请求老师提供必需的用品。
(1)实验探究的目的是___________________________。
(2)探究所依据的化学原理是_________________________(用必要的文字和化学方程式表示)。
(3)实验必需药品:金属钠、____________和_______________。该同学在探究实验中意外地发现生成的蓝色沉淀中混有少量的黑色难溶物,而所使用的药品均没有问题,你认为该黑色难溶物是____________,生成该黑色难溶物的原因是__________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等.用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如图1: 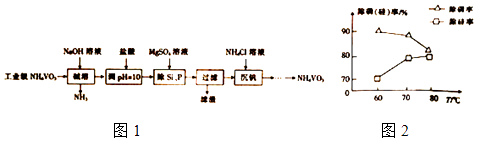
(1)碱溶时,下列措施有利于NH3逸出的是(填字母). a、升高温度 b、增大压吸 c、增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3 , 已知Ksp(MgSiO3)=2.4×l0﹣5 . 若滤液中c(SiO32﹣)=0.08mol/L,则c(Mg2+)= ②由图2可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和;但随着温度的升高,除硅率升高,其原因是(用离子方程式表示).
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率.加入蒸馏水的目的是
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛:CH3OH(g)HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1L的密闭容器中进行、甲醇的物质的量为1mol).下列有关说法中正确的是( ) 
A.脱氢反应的△H<0
B.600 K时,Y点甲醇的v(逆)<v(正)
C.从Y点到Z点可通过增大压强
D.在t1K时,该反应的平衡常数为8.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A.用溴水可鉴别苯、CCl4、己烯
B.加浓溴水,然后过滤可除去苯中少量己烯
C.苯、溴水、铁粉混合制成溴苯
D.可用分液漏斗分离己烷和苯的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法:2Cu+H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法II和方法III制取Cu2O而很少用方法I,其原因是 .
(2)己知:2Cu(s)+ ![]() O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+
O2(g)=Cu2O(s)△H=﹣akJmol﹣1C(s)+ ![]() O2(g)=CO(s)△H=﹣bkJmol﹣1
O2(g)=CO(s)△H=﹣bkJmol﹣1
Cu(s)+ ![]() O2(g)=CuO(s)△H=﹣ckJmol﹣1
O2(g)=CuO(s)△H=﹣ckJmol﹣1
则方法I发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=kJmol﹣1 .
(3)方法II采用离子交换膜控制电解液中OH﹣的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为 .
(4)方法III为加热条件下用液态拼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2 . 该制法的化学方程式为 .
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: 2H2O(g) ![]() 2H2(g)+O2(g)△H>0
2H2(g)+O2(g)△H>0
水蒸气的浓度随时间t变化如表所示.
序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是(填字母代号).
A.实验温度:T1<T2
B.实验①前20min的平均反应速率v(O2)=7×10﹣5mol/(Lmin)
C.实验②比实验①所用的催化剂效率高
(6)25℃时,向50mL0.018mol/L的AgNO3溶液中加入50mL0.02mol/L盐酸,生成沉淀.若已知Ksp(AgCl)=1.8×10﹣10 , 则此时溶液中的c(Ag+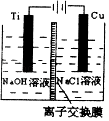
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com