
����Ŀ����100 mL NaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ����μ���0.2 mol��L��1�����ᣬ����CO2������������������֮���ϵ��ͼ��ʾ�������ж���ȷ����(����)

A. ԭNaOH��Һ��Ũ��Ϊ0.2 mol��L��1
B. ͨ��CO2�ڱ�״���µ����Ϊ448 mL
C. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaOH)��n(Na2CO3)��1��3
D. ������Һ�����ʳɷֵ����ʵ���֮��Ϊn(NaHCO3)��n(Na2CO3)��1��1
���𰸡�A
������������CO2�����ķ�ӦΪ��NaHCO3+HCl=NaCl+CO2��+H2O��̼���������ᷴӦ����̼�����Ƶķ���ʽΪ��Na2CO3+HCl=NaHCO3+NaCl���ɷ���ʽ��֪��ǰ��������������������Ӧ��ȣ�������ͼ���֪����CO2����������Һ�������100mL��25mL��75mL��25mL����˵��NaOH��CO2���巴Ӧ������Һ������ΪNa2CO3��NaHCO3��A������100mL����ʱ������̼����������ʱ��ҺΪNaCl��Һ�����������ӡ��������غ㣬����n��NaOH��=n��NaCl��=n��HCl��=0.1L��0.2mol/L=0.02mol������c��NaOH��=0.02mol��0.1L=0.2mol/L��A��ȷ��B�������߿�֪��25mL��100mLΪ̼�����������ᷴӦ���ɶ�����̼����Ӧ����ʽΪNaHCO3+HCl=NaCl+CO2��+H2O������n��CO2��=n��HCl��=��0.1L-0.025L����0.2mol/L=0.015mol������CO2�������Ϊ0.015mol��22.4L/mol=0.36L=336mL��B����C��Na2CO3ת��ΪNaHCO3��������Ϊ25mL������NaHCO3ת��Ϊ������̼�ֿ�����������25mL����NaOH��CO2���巴Ӧ������Һ��NaHCO3������������Ϊ75mL-25mL=50mL�����Na2CO3��NaHCO3�����ʵ���֮��Ϊ25mL��50mL=1��2��C����D����C�з�����֪D����ѡA��


 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д� �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з�Ӧ�ķ�Ӧ�ȣ�
��CH3COOH��l��+2O2��g��=2CO2 ��g��+2H2O��l����H=��870.3kJ�Mmol
��C��S��+O2��g��=CO2 ��g����H=��393.5kJ�Mmol
��2C��S��+2H2��g��+O2��g��=CH3COOH��l����H=��488.3kJ�Mmol
��д��H2ȼ���ȵ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƫ����泥�NH4VO3����Ҫ�����������߸ɼ���ýȾ���ȣ��ó�������ȥ��ҵ��ƫ������е����ʹ衢��������ͼ1�� 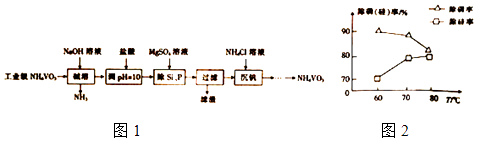
��1������ʱ�����д�ʩ������NH3�ݳ�����������ĸ���� a�������¶� b������ѹ�� c������NaOH��Һ��Ũ��
��2������������Ҫ�ɷ�ΪMg3��PO4��2��MgSiO3 �� ��֪Ksp��MgSiO3��=2.4��l0��5 �� ����Һ��c��SiO32����=0.08mol/L����c��Mg2+��= ����ͼ2��֪������һ������MgSO4��Һ��������ʱ�������¶ȵ����ߣ��������½�����ԭ�����¶����ߣ�Mg3��PO4��2�ܽ����������������¶ȵ����ߣ����������ߣ���ԭ�����������ӷ���ʽ��ʾ����
��3������ʱ����Ӧ�¶��������50�棬��ʵ���ҿɲ�ȡ�ļ��ȷ�ʽΪ
��4��̽��NH4Cl��Ũ�ȶԳ����ʵ�Ӱ�죬���ʵ�鲽�裨�����Լ���ѡ����ȡ����10mLһ��Ũ�ȵ���ҺA��B���ֱ����lmL��10mL��1mol/LNH4Cl��Һ������A�м���mL����ˮ������������Һ�¶Ⱦ�Ϊ50�桢pH��Ϊ8����ר�������������ʣ���������ˮ��Ŀ����
��5��ƫ����隣�����ˮ�е��ܽ�Ȳ����ڲ��ᣨH2C2O4����Һ������������ԭ��Ӧ���ܽ⣬ͬʱ��������NH4��2[��VO��2��C2O4��3]���÷�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�²�ϸ�����ڵ��ⶾ��Ϊ��ɫ��ϸ��״�ᾧ����С��������к�ǿ�Ķ��ԣ����������ѡ�Ż�¡���Ѫ�����εȣ����յ������������ⶾ��Ϊ��״�ģ��ṹʽ��ͼ��ʾ��

���ͼ�����ش���������⡣
(1)�û������к���________������İ�����________��������Ȼ���
(2)��ɸû�����İ�������_______�֣������ظ����ֵ�R����_______________����д��������Ľṹͨʽ��____________________________��
(3)�û����ﺬ��________���ļ���
(4)b����ʾ��R�������ɵİ��������Է���������________��
(5)���ⶾ���ڻ�״���γɹ�����ʧȥ��________��ˮ���ӣ���Է�������������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܻ�óɹ����ǣ� ��
A.����ˮ�ɼ��𱽡�CCl4����ϩ
B.��Ũ��ˮ��Ȼ����˿ɳ�ȥ����������ϩ
C.������ˮ�����ۻ���Ƴ��屽
D.���÷�Һ©�����뼺��ͱ��Ļ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K2Cr2O7��Һ�д���ƽ�⣺Cr2O72������ɫ��+H2O2CrO42������ɫ��+2H+ �� ��K2Cr2O7��Һ��������ʵ�飺 
���ʵ�飬����˵������ȷ���ǣ� ��
A.������Һ��ɫ���������Һ���
B.����Cr2O72����C2H5OH��ԭ
C.�ԱȢںܿ͢�֪K2Cr2O7������Һ������ǿ
D.������м���70%H2SO4��Һ����������Һ��Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״��������ȡ��ȩ��CH3OH��g��HCHO��g��+H2��g�����״���ƽ��ת�������¶ȱ仯������ͼ��ʾ����֪��Ӧ��1L���ܱ������н��С��״������ʵ���Ϊ1mol���������й�˵������ȷ���ǣ� �� 
A.���ⷴӦ�ġ�H��0
B.600 Kʱ��Y��״���v���棩��v������
C.��Y�㵽Z���ͨ������ѹǿ
D.��t1Kʱ���÷�Ӧ��ƽ�ⳣ��Ϊ8.1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����������з�һС���ƣ��������ۻ�ʱ���ò�����պȡ������ˮCuSO4���ۻ����ƽӴ���˲�����ҫ�۵Ļ�ͬʱ�к�ɫ�������ɡ��ݴ��ж�����˵���в���ȷ����

A��������Ӧ���û���Ӧ
B��������Ӧ�Ƿ��ȷ�Ӧ
C����������ˮ�����£�Na������CuSO4��Ӧ������Cu
D��������Ӧ��CuSO4�����˻�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij2L�����ܱ������г���2mol X��g����1mol Y��g��������Ӧ��2X��g��+Y��g��3Z��g����H����Ӧ�����г��������¶ȣ���û����ϵ��X������������¶ȵĹ�ϵ��ͼ��ʾ�������ƶ���ȷ���ǣ� �� 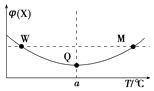
A.�����¶ȣ�ƽ�ⳣ����С
B.W��M����Y������Ӧ�������
C.ƽ������Z�ﵽ��ƽ��ʱZ�������������
D.M��ʱ��Y��ת�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com