
【题目】在200℃时,将amol H2(g)和bmol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)![]() 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)= ______,c(I2)= ______,而c(HI)=______,所以化学反应速率V正最大,而V逆最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)______,c(I2)______,而c(HI)______,从而化学反应速率v(正)______,而v(逆)______。
(3)当反应进行到v(正)与v(逆)相等时,此可逆反应就达到了平衡。
【答案】![]() mol·L-1
mol·L-1 ![]() mol·L-1 0 减小 减小 增大 减小 增大
mol·L-1 0 减小 减小 增大 减小 增大
【解析】
化学平衡的建立,开始时反应物浓度达到最大,生成物浓度为零,随着反应进行,反应物浓度不断减小,生成物浓度不断增加,正反应速率不断减小,逆反应速率不断增加。
⑴反应刚开始时,还未反应,反应物浓度为最大值,生成物浓度为0,根据浓度等于物质的量除以容器体积得c(H2)= ![]() molL1,c(I2)=
molL1,c(I2)= ![]() molL1,而c(HI)= 0,所以化学反应速率υ(正)最大,而υ(逆)最小(为零);故答案为:
molL1,而c(HI)= 0,所以化学反应速率υ(正)最大,而υ(逆)最小(为零);故答案为:![]() molL1;
molL1; ![]() molL1;0。
molL1;0。
⑵随着反应的进行,反应物浓度减小,生成物浓度增加,正反应速率减小,逆反应速率增加,因此反应混合物中各组分浓度的变化趋势为c(H2)减小,c(I2)减小,而c(HI) 增大,从而化学反应速率υ(正)减小,而υ(逆)增大;故答案为:减小;减小;增大;减小;增大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知BaSO4(s)![]() Ba2+(aq)+SO42﹣(aq),25℃时Ksp=1.07×10﹣10,且BaSO4的溶解度随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是
Ba2+(aq)+SO42﹣(aq),25℃时Ksp=1.07×10﹣10,且BaSO4的溶解度随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是
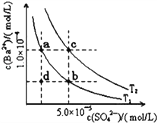
A. 温度为T1时,在T1曲线上方区域任意一点时,均有BaSO4沉淀生成
B. 蒸发溶剂可能使溶液由d点变为T1曲线上a、b之间的某一点
C. 升温可使溶液由b点变为d点
D. T2>25℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的实验装置和方法进行实验,能达到目的的是( )
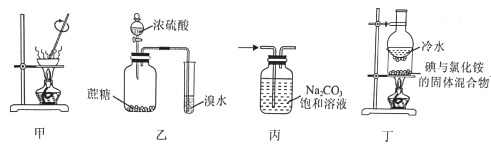
A.甲装置可将AlCl3溶液蒸干获得AlCl3晶体
B.乙装置可证明浓硫酸具有脱水性和氧化性
C.丙装置可除去CO2中的HCl
D.丁装置可将NH4Cl固体中的I2分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应A(g)+2B(g)=3C(g)+4D(g)中,表示该反应速率最快的是
A.v(A)=0.5mol/(L·s)
B.v(B)=0.5mol/(L·s)
C.v(C)=0.8mol/(L·s)
D.v(D)=1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应室(容积恒定为2L)中有反应:A(g)+2B(g)=C(g)。不能说明上述反应达到平衡状态的是( )
A.反应中A与B的物质的量浓度之比为1:2
B.混合气体总物质的量不再变化
C.混合气体的平均摩尔质量不随时间的变化而变化
D.2v正(A)=v逆(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:___Fe2++___ClO-+___=___Fe(OH)3↓+___C1-+___
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___(填操作名称)、过滤、洗涤。
Ⅱ.铵明矾(NH4Al(SO4)212H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理___;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是___。
(2)实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=___。
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___(填代号)。
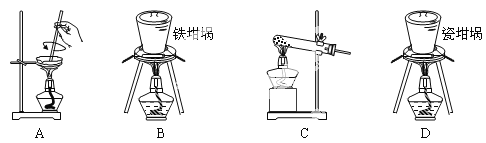
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂用闪锌矿制备锌及颜料 A(红棕色固体)的工艺流程如下图所示。(闪锌矿的主要成分为 ZnS,同时含有 10%的 FeS 及少量 CuS)
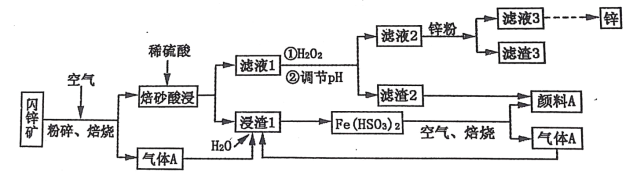
已知:①闪锌矿在焙烧时会生成副产物 ZnFeO4,ZnFeO4 不溶于水及硫酸。Fe(HSO3)2 难溶于水。②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是_______________________________________________________。
(2)“滤液 1”中选用足量的 H2O2,理由是_____________________。假设“②调节 pH"前,滤液 1 中 c(Fe3+)=1molL-1 ,则 Fe3+ 完全沉淀时的 pH 至少为____________________。(离子浓度≤ 10-6mol·L-1 规为完全除去)。
(3)“滤渣 3”的成分为__________________________________ (写化学式)。
(4)设计一种检验“颜料 A”中是否含有 Fe2+的实验方案_______________________________________________________。
(5)“气体 A”与“浸渣 1”反应的化学方程式为_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两种气体的分子数一定相等的是( )
A.温度相同、体积相同的O2和N2
B.质量相等、密度不等的N2和C2H4
C.体积相同、密度不相等的CO和C2H4
D.压强相同、体积相同的O2和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
①含有大量![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
②![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
③水电离的![]() 浓度为
浓度为![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
④加入Mg能放出![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
⑤![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
⑥![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
⑦使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
A.②⑥⑦B.①④⑤⑥C.②④⑥D.①③⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com