
【题目】下列各项叙述中正确的是( )
A.同一原子的能层越高,s电子云半径越大
B.在同一个电子层上运动的电子,其自旋方向肯定不同
C.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
D.镁原子的核外电子排布由1s22s22p63s2变为1s22s22p63p2时,释放能量
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应:A(g)+B(g) ![]() xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是
xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是
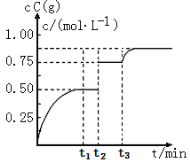
A. t2 时刻改变的条件是使用催化剂
B. t3时刻v(逆)可能小于t2 时刻v(逆)
C. t3时刻改变的条件一定是增大反应物的浓度
D. t1~t2、t2~t3平衡常数均为0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示,3分钟时达到平衡;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。
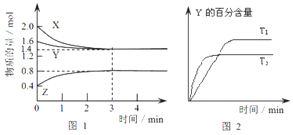
(1)容器中发生的反应可表示为_________________________;
(2)反应进行的前3min内,用X表示的反应速率v(X)=_____________;
(3)保持其他条件不变,升高温度,该反应的化学平衡将________方向移动;(填“正反应”或“逆反应”)
(4)①若X为有色气体,T℃ 时反应达平衡后,将反应容器的容积减少一半,则达到新的平衡后,容器内气体的颜色较原平衡时________;(填“变深、变浅或不变”)
②一定条件下的密闭容器中,该反应达到平衡,要提高气体Y的转化率,可以采取的措施是_________(填字母代号);
a.高温高压 b.加入催化剂 c.减少Z的浓度 d.增加气体Y的浓度
(5)在体积为2L的密闭容器中,充入2mol X和1mol Y进行反应,2min后反应达到平衡,此时平衡混合物中X为0.4mol/L,则Y的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中Ca2+的含量(100mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00mL血液样品,处理后配制成50.00mL溶液;
②准确量取溶液10.00mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00mL0.0010mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020mol·L-1(NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中c(Ca2+)≤1.0×10-5mol·L-1,应保持溶液中c(C2O42-)≥_____mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为_____。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将____(填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量_____(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D. 金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl的溶解平衡曲线如图所示。已知pAg=-lg c(Ag+)、pCl=-lg c(Cl-),利用pCl、pAg的坐标系可表示出AgCl的溶度积与溶液中c(Ag+)和c(Cl-)的相互关系。下列说法错误的是
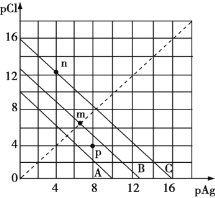
A. A线、B线、C线对应的温度关系:A>B>C
B. A线对应温度下,AgCl的Ksp=1×10-10
C. B线对应温度下,p点形成的溶液是AgCl的不饱和溶液
D. C线对应温度下,n点表示KCl与过量的AgNO3反应产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B. 图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C. 图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D. 图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排措施是我国“十一五”期间提出的政策措施。
(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式____________。
(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某硏究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g)![]() CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
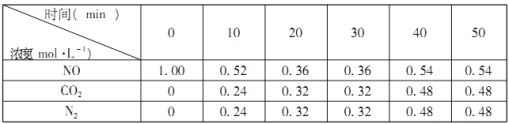
①0到10min内,NO的平均反应速率v(NO)=___________mol·L-1·min-1。
②下列数据不再变化可表示该反应达到平衡的是________________________。
a.容器内压强 b.混合气体的平均摩尔质量 c.混合气体的密度
③若容器改为可变容积容器,达平衡后,再充入少量NO气体,再次达到平衡时N2的浓度 ____________(填“增大”,“减小”,或“不变”)
(3)在某温度T时能同时发生反应:
2N2O5(g)![]() 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1
N2O4(g)![]() 2NO2(g) K2
2NO2(g) K2
若向一体积固定为2L的密闭容器内加入N2O5 2mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液(pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
____Fe2+ +_______ ______+____ _______ +____H2O=____Fe(OH)3 ↓+____HCO3
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作 | 现象 | |
实验IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
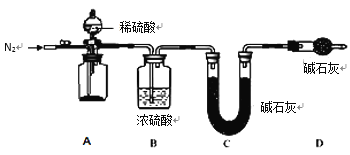
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com