
【题目】节能减排措施是我国“十一五”期间提出的政策措施。
(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。
C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式____________。
(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某硏究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g)![]() CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
CO2(g)+N2(g) △H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:
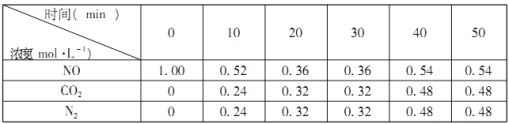
①0到10min内,NO的平均反应速率v(NO)=___________mol·L-1·min-1。
②下列数据不再变化可表示该反应达到平衡的是________________________。
a.容器内压强 b.混合气体的平均摩尔质量 c.混合气体的密度
③若容器改为可变容积容器,达平衡后,再充入少量NO气体,再次达到平衡时N2的浓度 ____________(填“增大”,“减小”,或“不变”)
(3)在某温度T时能同时发生反应:
2N2O5(g)![]() 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1
N2O4(g)![]() 2NO2(g) K2
2NO2(g) K2
若向一体积固定为2L的密闭容器内加入N2O5 2mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=___________。
【答案】C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1 0.048 bc 不变 0.16
【解析】
(1)①C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1
②H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
③CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据盖斯定律①-②-③可得;
(2)①根据v=c÷t计算;
②根据平衡状态特征分析;
③根据压强对反应的影响可得;
(3)一体积固定为2L的密闭容器,容器内的反应达到平衡,此时n(NO2)=0.4mol,c(NO2)=0.2mol/L,已知K2=0.1,则容器中有c2(NO2)÷c(N2O4)=0.1,可得c(N2O4)=0.4mol/L,根据反应N2O4(g)2NO2(g)得到0.2mol/L的NO2则消耗N2O40.1mol/L,则由反应2N2O5(g)2N2O4(g)+O2(g)生成的N2O4有0.5mol/L,再根据反应解得各物质的浓度,计算K1;
(1)①C(s)+O2(g)=CO2(g)△H=393.5kJmol1
②H2(g)+ ![]() O2(g)=H2O(g) △H=-242.0kJ·mol-1
O2(g)=H2O(g) △H=-242.0kJ·mol-1
③CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ·mol-1
O2(g)=CO2(g) △H=-283.0kJ·mol-1
根据盖斯定律①②③得C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1;
故答案为:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ·mol-1;
(2)①0到10min内,NO的平均反应速率v(NO)=(1.00mol/L0.52mol/L)÷10min=0.048 mol·L-1·min-1;
故答案为:0.048;
②a.反应C(s)+2NO(g)![]() CO2(g)+N2(g)是个气体体积不变的反应,容器内压强始终保持不变,故a错误;
CO2(g)+N2(g)是个气体体积不变的反应,容器内压强始终保持不变,故a错误;
b.根据M=m混÷n,混合气体的质量增大,n不变,平均摩尔质量增大,混合气体平均摩尔质量不变时达到平衡,故b正确;
c.跟ρ=m混÷V,混合气体的质量增大,体积不变,混合气体的密度增大,混合气体的密度时达到平衡,故c正确;
故答案为:bc;
③若容器改为可变容积容器达平衡后改变某一条件,一段时间后,反应再次达到原平衡,因为反应是个气体体积不变的反应,故压强对其平衡无影响,故可以是增加NO浓度;
故答案为:增加NO浓度;
(3) 一体积固定为2L的密闭容器,容器内的反应达到平衡,此时n(NO2)=0.4mol,c(NO2)=0.2mol/L,已知K2=0.1,则容器中有c2(NO2)÷c(N2O4)=0.1,
可得c(N2O4)=0.4mol/L,根据反应N2O4(g)2NO2(g)得到0.2mol/L的NO2则消耗N2O40.1mol/L,则由反应2N2O5(g
故答案为:0.16;


科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+ 1/2O2(g) ![]() SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
SO3(g) ΔH=―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
A. 196.64kJB. 小于98.32kJ
C. 小于196.64kJD. 大于196.64kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中正确的是( )
A.同一原子的能层越高,s电子云半径越大
B.在同一个电子层上运动的电子,其自旋方向肯定不同
C.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
D.镁原子的核外电子排布由1s22s22p63s2变为1s22s22p63p2时,释放能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=8.0×10-38,Kb(NH3·H2O)=1.8×10-5,下列叙述中不正确的是
A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀
B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂
C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强
D.25℃时,![]() +H2O
+H2O![]() NH3·H2O+H+的平衡常数为5.6×10-10
NH3·H2O+H+的平衡常数为5.6×10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是从海藻灰和智利硝石矿层中提取碘的主要反应:①2NaI+MnO2+3H2SO4===2NaHSO4+MnSO4+2H2O+I2 ;②2NaIO3+5NaHSO3===2Na2SO4+3NaHSO4+H2O+I2下列说法正确的是( )
A. 氧化性:MnO2>SO![]() >IO
>IO![]() >I2
>I2
B. I2在反应①中是还原产物,在反应②中是氧化产物
C. 反应①②中生成等量的I2时转移电子数之比为1∶5
D. NaHSO3溶液呈酸性,NaHSO3溶液中c(HSO![]() )>c(H2SO3)>c(SO
)>c(H2SO3)>c(SO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42-、CO32-、I-、Cl-中的一种或多种,进行如图所示的实验,下列说法正确的是 ( )

A. 溶液X中有Fe3+、SO42-
B. 溶液X中有Fe2+、I-可能有SO42-、Cl-
C. 溶液X中有I-、Cl-,无CO32-
D. 溶液X中有I-,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O![]() 2H++2CrO42-(黄色)。
2H++2CrO42-(黄色)。
①向2mL0.1mol·L-1K2Cr2O7溶液中滴入3滴6mol·L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:Cr2O72-+8H++3SO32-=2Cr3+(绿色)+3SO42-+4H2O。下列分析正确的是()
A.CrO42-和S2-在酸性溶液中可大量共存
B.实验②说明氧化性:Cr2O72->SO42-
C.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
D.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如下图,实验中Y装置产生白色沉淀。下列说法不正确的是

A. 滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2
B. Y中产生的白色沉淀是BaSO4或BaSO3
C. 产生白色沉淀的原因可能是在酸性条件下SO2与NO3- 反应生成了SO42-
D. 若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,说明Fe3+也能将SO2氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
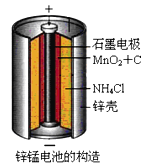
【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示:
![]()
(1)锌锰干电池的电路中每通过![]() ,理论上负极质量减少 ______ g;工作时
,理论上负极质量减少 ______ g;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______
的微粒,正极的电极反应式是 ______
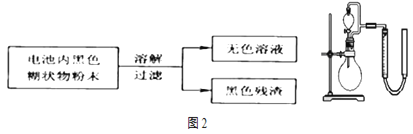
(2)某研究小组对电池内黑色糊状物进行了下列实验:
已知:![]() 是两性氢氧化物,完成下列实验报告:
是两性氢氧化物,完成下列实验报告:
实验步骤 | 实验现象 | 实验结论和解释 |
取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ | 无色溶液中存在 检验 |
(3)利用残渣中分离出的![]() ,研究其在
,研究其在![]() 制
制![]() 过程中的作用.实验装置如图2所示。将等物质的量浓度、等体积
过程中的作用.实验装置如图2所示。将等物质的量浓度、等体积![]() 溶液加入烧瓶中,分别进行2个实验
溶液加入烧瓶中,分别进行2个实验![]() 气体的体积在相同条件下测定
气体的体积在相同条件下测定![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量 | 收集到56mL气体 |
|
实验二 | 足量 | 黑色粉末部分溶解,收集到112mL气体 |
|
实验1、2中参加反应的![]() 的物质的量之比为 ______ ,实验二中反应的离子方程式为 ______。
的物质的量之比为 ______ ,实验二中反应的离子方程式为 ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com