
����Ŀ��п�̸ɵ��������ʹ�õĻ�ѧ��أ������������ͼ1��ʾ��
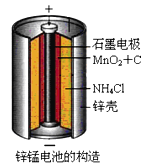
![]()
��1��п�̸ɵ�صĵ�·��ÿͨ��![]() �������ϸ����������� ______ g������ʱ
�������ϸ����������� ______ g������ʱ![]() �����������ŵ�����������壬����һ����������Ǻ�
�����������ŵ�����������壬����һ����������Ǻ�![]() �����������ĵ缫��Ӧʽ�� ______
�����������ĵ缫��Ӧʽ�� ______
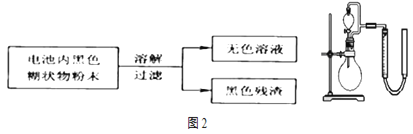
��2��ij�о�С��Ե���ں�ɫ��״�����������ʵ�飺
��֪��![]() ��������������������ʵ�鱨�棺
��������������������ʵ�鱨�棺
ʵ�鲽�� | ʵ������ | ʵ����ۺͽ��� |
ȡ����������ɫ��Һ�������У���μ���NaOH��Һ��ֱ���������ټ��� | ���ɰ�ɫ������ ______ | ��ɫ��Һ�д��� ���� |
��3�����ò����з������![]() ���о�����
�������![]() ��
��![]() �����е����ã�ʵ��װ����ͼ2��ʾ���������ʵ���Ũ�ȡ������
�����е����ã�ʵ��װ����ͼ2��ʾ���������ʵ���Ũ�ȡ������![]() ��Һ������ƿ�У��ֱ����2��ʵ��
��Һ������ƿ�У��ֱ����2��ʵ��![]() ������������ͬ�����²ⶨ
������������ͬ�����²ⶨ![]() ��
��
��� | ��ƿ�е����� | ʵ���¼ | ʵ���������� |
ʵ��һ | ���� | �ռ���56mL���� |
|
ʵ��� | ���� | ��ɫ��ĩ�����ܽ⣬�ռ���112mL���� |
|
ʵ��1��2�вμӷ�Ӧ��![]() �����ʵ���֮��Ϊ ______ ��ʵ����з�Ӧ�����ӷ���ʽΪ ______��
�����ʵ���֮��Ϊ ______ ��ʵ����з�Ӧ�����ӷ���ʽΪ ______��
���𰸡�![]()
![]() ��ɫ�������ܽ⣬�����̼�����ζ������
��ɫ�������ܽ⣬�����̼�����ζ������ ![]() 1��1
1��1 ![]()
��������
��1��п�̸ɵ�صĸ�����Znʧȥ���ӣ�������ӦΪ![]() ����������1molʱת��2mol���ӣ�ÿͨ��
����������1molʱת��2mol���ӣ�ÿͨ��![]() ��������������
��������������![]() ����
����![]() �����������ŵ����2�����壬����һ����������Ǻ�
�����������ŵ����2�����壬����һ����������Ǻ�![]() ����Ϊ��������һ��Ϊ������������ӦΪ
����Ϊ��������һ��Ϊ������������ӦΪ![]() ��
��
�ʴ�Ϊ��![]() ��
��![]() ��
��
��2����ɫ��Һ�к�![]() ��
��![]() ���Ӽ��������Ӧ�������ɵİ�ɫ�������ܽ���ǿ����Һ�У�笠�������Ӧ�����д̼�����ζ������Ϊ�������������ɵİ���������Һ���ȣ�����ʪ��ĺ�ɫʯ����ֽ���ڲ�������һ�������Թܿڣ��۲쵽��ɫʯ����ֽ������֤����笠����ӣ��䷢�������ӷ�Ӧ����ʽΪ��
���Ӽ��������Ӧ�������ɵİ�ɫ�������ܽ���ǿ����Һ�У�笠�������Ӧ�����д̼�����ζ������Ϊ�������������ɵİ���������Һ���ȣ�����ʪ��ĺ�ɫʯ����ֽ���ڲ�������һ�������Թܿڣ��۲쵽��ɫʯ����ֽ������֤����笠����ӣ��䷢�������ӷ�Ӧ����ʽΪ��![]() ,
,
�ʴ�Ϊ����ɫ�������ܽ⣬�����̼�����ζ�����壻![]() ��
��
��3�������ʵ���Ũ�ȡ������![]() ��Һ�����Һ©���У�ʵ��һ�й�������������������ǻ�ԭ����ʵ�����
��Һ�����Һ©���У�ʵ��һ�й�������������������ǻ�ԭ����ʵ�����![]() �ǻ�ԭ���������������1��2��֪�������ʵ����Ĺ����������ȫ��Ӧ����μӷ�Ӧ��
�ǻ�ԭ���������������1��2��֪�������ʵ����Ĺ����������ȫ��Ӧ����μӷ�Ӧ��![]() �����ʵ���֮��Ϊ1��1��ʵ����з�Ӧ���������ӡ�ˮ�����������ӷ�ӦΪ
�����ʵ���֮��Ϊ1��1��ʵ����з�Ӧ���������ӡ�ˮ�����������ӷ�ӦΪ![]() ��
��
�ʴ�Ϊ��1��1��![]() ��
��


 ���������ν�ϵ�д�
���������ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܼ��Ŵ�ʩ���ҹ���ʮһ�����ڼ���������ߴ�ʩ��
(1)ú��ȼ�գ�����������к����塣��úת��Ϊˮú��������Ч�����ŷš�
C(s)+O2(g)=CO2(g) ��H=��393.5 kJ��mol��1
H2(g)+ ![]() O2(g)=H2O(g) ��H=��242.0kJ��mol��1
O2(g)=H2O(g) ��H=��242.0kJ��mol��1
CO(g)+![]() O2(g)=CO2(g) ��H=��283.0kJ��mol��1
O2(g)=CO2(g) ��H=��283.0kJ��mol��1
�����������ݣ�д��C(s)��ˮ������Ӧ����CO��H2���Ȼ�ѧ����ʽ____________��
(2)����β�����ŷ��Ǵ�����Ⱦ�����Ҫ��Դ�����к���NO���塣����������ʾ�û���̿��ԭ�����Դ����������ij�x��С����̶��ݻ����ܱ������м���һ�����Ļ���̿��NO������ӦC(s)+2NO(g)![]() CO2(g)+N2(g) ��H=��574kJ��mol��1�������¶�Tʱ�����ⷴӦ�����Ƴ��±���
CO2(g)+N2(g) ��H=��574kJ��mol��1�������¶�Tʱ�����ⷴӦ�����Ƴ��±���
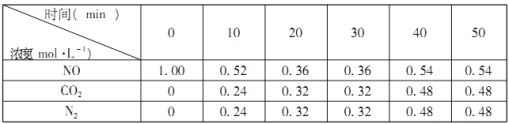
��0��10min�ڣ�NO��ƽ����Ӧ����v(NO)=___________mol��L��1��min��1��
���������ݲ��ٱ仯�ɱ�ʾ�÷�Ӧ�ﵽƽ�����________________________��
a.������ѹǿ b����������ƽ��Ħ������ c�����������ܶ�
����������Ϊ�ɱ��ݻ���������ƽ����ٳ�������NO���壬�ٴδﵽƽ��ʱN2��Ũ�� ____________������������������С����������������
(3)��ij�¶�Tʱ��ͬʱ������Ӧ��
2N2O5(g)![]() 2N2O4(g)+O2(g) K1
2N2O4(g)+O2(g) K1
N2O4(g)![]() 2NO2(g) K2
2NO2(g) K2
����һ����̶�Ϊ2L���ܱ������ڼ���N2O5 2mol��һ��ʱ��������ڵķ�Ӧ�ﵽƽ�⣬��ʱn(NO2)=0.4mol����֪K2=0.1��������K1=___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����������ɫ���壬������ˮ����һ����Ҫ�Ĺ�ҵԭ�ϣ��������Ʊ���Ѫ������������Ҳ�������ɳ���صĵ缫��ij�о�С��ͨ������ʵ�飬Ѱ�����ø��ֽⷴӦ�Ʊ� FeCO3 ��������ѷ�����
ʵ�� | �Լ� | ���� | |
�ι� | �Թ� | ||
| 0.8 mol/L FeSO4 ��Һ��pH=4.5�� | 1 mol/L Na2CO3 ��Һ��pH=11.9�� | ʵ������������������ɫ������5min ��������Եĺ��ɫ |
0.8 mol/L FeSO4 ��Һ��pH=4.5�� | 1 mol/L NaHCO3 ��Һ ��pH=8.6�� | ʵ������������ɫ������������ɫ���ݣ�2min ��������ԵĻ���ɫ | |
0.8 mol/L (NH4)2Fe(SO4)2 ��Һ��pH=4.0�� | 1 mol/L NaHCO3 ��Һ ��pH=8.6�� | ʵ������������ɫ��������ɫ���ݣ��ϳ�ʱ�䱣�ְ�ɫ | |
(1)ʵ�� I �к��ɫ����������ԭ��������·�Ӧ��ʾ���벹ȫ��Ӧ��
____Fe2+ +_______ ______+____ _______ +____H2O=____Fe(OH)3 ��+____HCO3
(2)ʵ�� II �в��� FeCO3 �����ӷ���ʽΪ_____________________________��
(3)Ϊ��̽��ʵ�� III �� NH4+��������ã���ͬѧ�����ʵ�� IV ����̽����
���� | ���� | |
ʵ��IV | �� 0.8 mol/L FeSO4 ��Һ�м�����__________���ټ��� Na2SO4 �������Ƴɻ����Һ����֪ Na+��ʵ����Ӱ�죬���Ի�Ϻ���Һ����仯������ȡ����Һһ�ιܣ��� 2mL 1 mol/L NaHCO3 ��Һ��� | ��ʵ�� III ������ͬ |
ʵ�� IV �м��� Na2SO4 �����Ŀ������_______________________��
�Ա�ʵ�� II��III��IV����ͬѧ�ó����ۣ�NH4+ˮ����� H+��������Һ pH�������˸��� Fe(OH)2 �IJ�����
��ͬѧ��Ϊ��ʵ�鷽�������Ͻ���Ӧ����ĶԱ�ʵ������ǣ���_____________����ȡ����Һһ�ιܣ���2mL 1 mol/L NaHCO3 ��Һ��ϡ�
(4)С��ͬѧ��һ��������Ϊ������ʵ��������ֱ��֤��ʵ�� III �� FeCO3 �Ĵ�����ߣ���Ҫ������ͼ��ʾ��װ�ý��ж����ⶨ���ֱ�ʵ�� I��II��III �еij������й��ˡ�ϴ�ӡ�����������Ȼ��ת���� A ���Ĺ��ƿ�С�
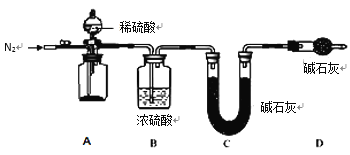
Ϊ�ⶨ FeCO3 �Ĵ��ȣ�����Ʒ�������⣬����ⶨ����������______________________��
(5)ʵ�鷴˼�����ⶨ��ʵ�� III �е� FeCO3 ���ȸ��ڷ��� I �ͷ��� II��ͨ������ʵ��������Ʊ� FeCO3 ʵ��ɹ��Ĺؼ�������__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��N��Ti��Mn��Cu������Ҫ�IJ���Ԫ�أ��䵥�ʼ�����������������ж��й㷺��Ӧ�á�
��1��Mnλ��Ԫ�����ڱ���_________����Mn2���ļ۲�����Ų�ͼΪ_____��
��2��Nԭ�Ӻ�����______�ֿռ��˶�״̬��ͬ�ĵ��ӡ�NO2+ �����幹����_________��������Ϊ�ȵ�����ķ�����________��д��һ�֣���
��3��Cu2����NH3���γ�[Cu(NH3)4]2�������ӣ�0.5 mol [Cu(NH3)4]2���к��������ĸ���Ϊ_____����֪NF3��NH3������ͬ�Ŀռ乹�ͣ���NF3������Cu2���γ������ӣ���ԭ����___________________________________________________________��
��4������TiO2��һ��Ӧ�ù㷺�Ĵ����������һ��ʵ����ͼ��ʾ�����������̼ԭ�ӵ��ӻ���ʽΪ___________����������ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ___________���������ҵķе����Ը��ڻ�����ף���Ҫԭ����______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����U�ιܡ�����Ϊmg������������Ϊmg��̼����1L0.2mol��L-1CuCl2��Һ�����ͼ��ʾװ�ã�����˵������ȷ������ ��

A. ��K,���������Ϻ�ɫ��������
B. �պ�K,̼�������Ϻ�ɫ��������
C. �պ�K,̼�����淢���ĵ缫��ӦΪCu2++2e-=Cu
D. �պ�K,����·����0.3NA������ͨ��ʱ��������̼����������������Ϊ9.6g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���һ���ݻ�Ϊ2L���ܱ������ڣ�Ԥ�ȼ��������ͨ��2molNH3������һ��ʱ���������ڵ�ѹǿΪ��ʼʱ��1.2��.��NH3��ת����Ϊ��������
A. 25%B. 80%C. 10%D. 20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij�¶ȣ�t�棩ʱ��ˮ��KW=10-13������¶ȣ�����ڡ����ڻ�С�ڣ�______25�棬�����¶���pH=11��NaOH��ҺaL��pH=1��H2SO4��ҺbL��ϣ�
�������û����ҺΪ���ԣ���a��b=_________��
�������û����ҺpH=2����a��b=__________��
��2����FeCl3��Һ���ɣ����գ����õ�����Ҫ��������� ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������·�Ӧ2SO2(g)+O2(g)![]() 2SO3(g)�ں����ܱ������н��У��ӷ�Ӧ��ʼ��10sʱ��O2��Ũ�ȼ�����0.3mol/L��0~10s��ƽ����Ӧ����Ϊ
2SO3(g)�ں����ܱ������н��У��ӷ�Ӧ��ʼ��10sʱ��O2��Ũ�ȼ�����0.3mol/L��0~10s��ƽ����Ӧ����Ϊ
A. v(O2)=0.3mol.L-1.s-1B. v(O2)=0.03mol.L-1.s-1
C. v(SO2)=0.03mol.L-1.s-1D. v(SO3)=0.03mol.L-1.s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ��ѧʵ�������߽����ã�����������������ɫ��ѧ������

��ʵ�����ռ���������ͼ1��ʾװ��
��ʵ�������������Ƶķ�Ӧʵ��ʱ����ͼ2��ʾװ��
��ʵ�������ò������ֱ�պȡŨ�����Ũ��ˮ����������������ε�ʵ��
��ʵ�����в���ͼ3��ʾװ�ý���ͭ��ϡ����ķ�Ӧ
A. �ڢۢ�B. �٢ڢ�C. �٢ڢ�D. �٢ۢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com