
【题目】在一定温度下,向一个容积为2L的密闭容器内(预先加入催化剂)通入2molNH3,经过一段时间后,测得容器内的压强为起始时的1.2倍.则NH3的转化率为( )
A. 25%B. 80%C. 10%D. 20%
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
A.某温度下,一元弱酸HA的Ka越小,则NaA的![]() 水解常数
水解常数![]() 越小
越小
B.铁管镀锌层局部破损后,铁管仍不易生锈
C.反应活化能越高,该反应越易进行
D.水在常温下的电离平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断正确的是( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1的取值范围为0mol·L-1<c1<0.14mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s) + 2B(g)![]() C(g) + D(g) 已达到平衡状态‘
C(g) + D(g) 已达到平衡状态‘
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量
A. ②③⑤ B. ①②③ C. ②③④ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁的主要反应为:3CO(g)+Fe2O3(s)3CO2(g)+2Fe(s),已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
下列说法正确的是( )
A.增加Fe2O3固体可以提高CO的转化率
B.减小容器体积既能提高反应速率又能提高平衡转化率
C.该反应的正反应ΔH<0
D.当容器内气体密度恒定时,不标志该反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H· (氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH (羟基自由基)。下列说法错误的是( )。
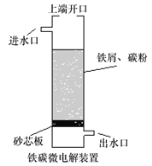
A.无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B.不鼓入空气时,正极的电极反应式为H++e-= H·
C.鼓入空气时,每生成1mol·OH有2mol电子发生转移
D.处理含有草酸(H2C2O4)的污水时,上端开口不需要应打开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒的化合物常用于制催化剂和新型电池。回答下列问题:
(1) V2O5为黄褐色固体,无味、有毒,微溶于水,是许多反应的催化剂。25℃时,部分含钒微粒的存在形式、浓度及存在的pH范围之间的变化关系如图所示(其余可溶性微粒均未标出),图中“[V]”表示含钒微粒的浓度,虚线表示[V]或pH的范围尚未确定。
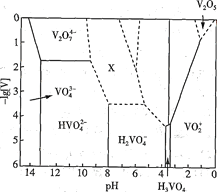
①V2O5溶于足量1.0 mol·L-1NaOH溶液中,发生反应的离子方程式为_____________________
②上述滴加H2SO4溶液的过程中,先后发生如下反应:

则“X所示区域的离子”不可能是____________(填标号)。
A.V3O93- B.V4 O103- C.V4 O124-
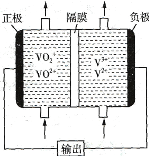
(2)如图所示为可充电的全钒液流电池构造示意图,该电池中的隔膜只允许H+通过。电池放电时,负极区溶液的pH将_________ (填“增大”“减小”或“不变”),电池充电时,阳极的电极反应式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·(L· s)-1 B. v(B)=0.3 mol·(L· s)-1
C. v(C)=0.8 mol·(L· s)-1 D. v(D)=1 mol·(L· s)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com