
����Ŀ����¯��������Ҫ��ӦΪ��3CO(g)+Fe2O3(s)3CO2(g)+2Fe(s)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
�¶�/�� | 1000 | 1150 | 1300 |
ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
����˵����ȷ���ǣ� ��
A.����Fe2O3����������CO��ת����
B.��С�������������߷�Ӧ�����������ƽ��ת����
C.�÷�Ӧ������Ӧ��H<0
D.�������������ܶȺ㶨ʱ������־�÷�Ӧ�Ѵﵽƽ��״̬

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:pK=-lgK��25��ʱ����Ԫ��H2A��pK1=1.85��pK2=7.19��25��ʱ,��0.1mol/LNaOH��Һ�ζ�20mL0.1mol/LH2A��Һ�ĵζ�������ͼ��ʾ������˵����ȷ����

A. a��������Һ��:Vo=10mL
B. C��������Һ��:c(A2-)=c(HA-)
C. b��������Һ��:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d��������Һ��:A2-��ˮ��ƽ�ⳣ��K1=1��10-7.19
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)�����д�ʩ��ʹ��Ӧ���л���Ӱٷ�������ѧ��Ӧ���ʺͻ�ѧƽ�ⳣ�����仯���ǣ� ��
2SO3(g)�����д�ʩ��ʹ��Ӧ���л���Ӱٷ�������ѧ��Ӧ���ʺͻ�ѧƽ�ⳣ�����仯���ǣ� ��
A. ����ѹǿ B. �����¶� C. ʹ�ô��� D. ���O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�Һϳ���һ���µĻ������ṹʽ��ͼ��ʾ���������� W��X��Y��Z��M�Ƕ������г���Ԫ�أ���ԭ����������������֪MԪ��ԭ�Ӻ������������YԪ��ԭ�Ӻ��� ��������������������˵���д������
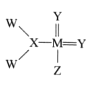
A.��X��Y����Ԫ���γɵĻ������ж���
B.W��ZԪ��λ�����ڱ���ͬһ����
C.Ԫ�صķǽ�����ǿ��˳��Ϊ��Z��Y��X
D.Y��MԪ�ص���̬�⻯��е�ߵ�Ϊ��Y��M
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���һ���ݻ�Ϊ2L���ܱ������ڣ�Ԥ�ȼ��������ͨ��2molNH3������һ��ʱ���������ڵ�ѹǿΪ��ʼʱ��1.2��.��NH3��ת����Ϊ��������
A. 25%B. 80%C. 10%D. 20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ˮ�γɵı�����Һ�У��������µ��ܽ�ƽ��͵���ƽ�⣺NH3+H2O![]() NH3H2O��NH3H2O
NH3H2O��NH3H2O![]() NH4++OH-����Щƽ�ⶼ������������ԭ���������Ѵﵽƽ�����ϵ��ͨ���������ʣ�����ա�
NH4++OH-����Щƽ�ⶼ������������ԭ���������Ѵﵽƽ�����ϵ��ͨ���������ʣ�����ա�
��1����������������ƽ����___����������������������ͬ����Ӧ�����ƶ���
��2��ͨ��HCl���壬ƽ����___��Ӧ�����ƶ���c��NH4+��___������������������С������ͬ����
��3������NaOH���壬ƽ����___��Ӧ�����ƶ���c��OH-��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪��2H2(g) + O2(g) == 2H2O(g)����H= �C483.6 kJ��mol-1, H2(g) + ![]() O2(g) == H2O(l) ��H=�C285.8 kJ��
O2(g) == H2O(l) ��H=�C285.8 kJ��![]() ,�ɴ˿�֪���ڵ���������45gҺ̬ˮ������___________kJ��������
,�ɴ˿�֪���ڵ���������45gҺ̬ˮ������___________kJ��������
��2����ҵ��������һ����Ҫ��Ӧ�ǣ�CO(g)+H2O(g)==CO2(g)+H2(g)����֪25��ʱ��
C(ʯī)+O2(g)==CO2(g)��H1����394kJ��mol-1
C(ʯī)+![]() O2(g)==CO(g)��H2����111kJ��mol-1
O2(g)==CO(g)��H2����111kJ��mol-1
H2(g)+![]() O2(g)==H2O(g)��H3����242kJ��mol-1
O2(g)==H2O(g)��H3����242kJ��mol-1
�Լ���25��ʱCO(g)+H2O(g)==CO2(g)+H2(g)�ġ�H=______kJ��mol-1
��3�� ��25�桢101KPaʱ��___ʱ���ų��������������÷�Ӧ��ȼ���ȡ���25�桢101KPaʱ��1g�Ҵ���ȫȼ������CO2��Һ̬ˮʱ����29.713kJ�����ܱ�ʾ�Ҵ�ȼ���ȵ��Ȼ�ѧ����ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2 mol B������2 L�������л�ϲ���һ�������·������·�Ӧ��2A������+B������![]() 2C������������2 s���룩����C��Ũ��Ϊ0.6 mol��L��1���������м���˵����
2C������������2 s���룩����C��Ũ��Ϊ0.6 mol��L��1���������м���˵����
��������A��ʾ�ķ�Ӧƽ������Ϊ0.3 mol��L��1��s��1
��������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6 mol��L��1��s��1
��2sʱ����A��ת����Ϊ70%
��2sʱ����B��Ũ��Ϊ0.7 mol��L��1
������ȷ���ǣ�
A.�٢�B.�٢�C.�ڢ�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ�ַ�����Ϊ28����̬��������AΪ��Ҫԭ�Ϻϳ�һ�־��й���ζ������E����ϳ�·������ͼ��ʾ

��ش��������⣺
(1)д��A�Ľṹ��ʽ________��
(2)B��D�����еĹ��������Ʒֱ���_____��_______��
(3)д����Ӧ�ٵĻ�ѧ����ʽ�� ____________ �� ��Ӧ���ͣ�___________ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com