
【题目】(1)已知:2H2(g) + O2(g) == 2H2O(g);△H= –483.6 kJ·mol-1, H2(g) + ![]() O2(g) == H2O(l) △H=–285.8 kJ·
O2(g) == H2O(l) △H=–285.8 kJ·![]() ,由此可知,在等温下蒸发45g液态水需吸收___________kJ的热量。
,由此可知,在等温下蒸发45g液态水需吸收___________kJ的热量。
(2)工业制氢气的一个重要反应是:CO(g)+H2O(g)==CO2(g)+H2(g),已知25℃时:
C(石墨)+O2(g)==CO2(g)△H1=-394kJ·mol-1
C(石墨)+![]() O2(g)==CO(g)△H2=-111kJ·mol-1
O2(g)==CO(g)△H2=-111kJ·mol-1
H2(g)+![]() O2(g)==H2O(g)△H3=-242kJ·mol-1
O2(g)==H2O(g)△H3=-242kJ·mol-1
试计算25℃时CO(g)+H2O(g)==CO2(g)+H2(g)的△H=______kJ·mol-1
(3) 在25℃、101KPa时,___时所放出的热量,叫做该反应的燃烧热。在25℃、101KPa时,1g乙醇完全燃烧生成CO2和液态水时放热29.713kJ,则能表示乙醇燃烧热的热化学方程式为________。
【答案】110 -41 1mol纯物质完全燃烧生成稳定的氧化物 C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJmol-1
【解析】
(1) ①2H2(g) + O2(g) == 2H2O(g);△H= –483.6 kJ·mol-1,
②H2(g) + ![]() O2(g) == H2O(l) △H=–285.8 kJ·
O2(g) == H2O(l) △H=–285.8 kJ·![]() ,
,
根据盖斯定律计算①-②×2得到:H2O(l)= H2O(g) △H=+44kJ/mol,蒸发45g液态水物质的量![]() ,需吸收的热量
,需吸收的热量![]() ;
;
(2)已知在25℃时:
(1)C(石墨)![]() ═
═![]()
(2)![]() ═
═![]()
(3)C(石墨)![]() ═
═![]()
由盖斯定律,(3)-(2)-(1)得![]() ═
═![]() ,
,
(3)燃烧热是指:在25℃、101kPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量;1g乙醇完全燃烧生成![]() 和液态水时放热
和液态水时放热![]() ,则1mol乙醇,质量为46g,完全燃烧生成稳定的氧化物放出的热量为:
,则1mol乙醇,质量为46g,完全燃烧生成稳定的氧化物放出的热量为:![]() ,其燃烧热的热化学方程式为:
,其燃烧热的热化学方程式为:![]() ═
═![]() 。
。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。B.在洗净的试管里配制银氨溶液。C.沿试管壁加入乙醛稀溶液。D.加热。请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目是___。
(2)简述银氨溶液的配制过程:___。
(3)步骤D应选择的加热方法是___(填下列装置编号),理由是___。
(4)乙醛发生银镜反应的化学方程式___。
(5)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
1 | 1 | 3 | 65 | 11 | 5 |
2 | 1 | 3 | 45 | 11 | 6.5 |
3 | 1 | 5 | 65 | 11 | 4 |
①实验1和实验2,探究的是___。
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为50℃,反应混合液pH为11时,出现银镜的时间___。(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成银镜的___。
(6)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。实验室从反应后的废液中回收银的实验流程如下:

已知:[Ag(NH3)2]![]() 在溶液中存在平衡:[Ag(NH3)2]+
在溶液中存在平衡:[Ag(NH3)2]+![]() Ag
Ag![]() +2NH3。
+2NH3。
①写出废液与稀HNO3反应的离子方程式___。
②加入的铁粉要过量的目的是___。
③该实验过程中可能产生的大气污染物是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s) + 2B(g)![]() C(g) + D(g) 已达到平衡状态‘
C(g) + D(g) 已达到平衡状态‘
①混合气体的压强 ②混合气体的密度
③B的物质的量浓度 ④气体的总物质的量
⑤混合气体总质量
A. ②③⑤ B. ①②③ C. ②③④ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁的主要反应为:3CO(g)+Fe2O3(s)3CO2(g)+2Fe(s),已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
下列说法正确的是( )
A.增加Fe2O3固体可以提高CO的转化率
B.减小容器体积既能提高反应速率又能提高平衡转化率
C.该反应的正反应ΔH<0
D.当容器内气体密度恒定时,不标志该反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H· (氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH (羟基自由基)。下列说法错误的是( )。
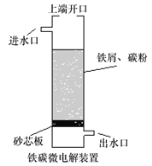
A.无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B.不鼓入空气时,正极的电极反应式为H++e-= H·
C.鼓入空气时,每生成1mol·OH有2mol电子发生转移
D.处理含有草酸(H2C2O4)的污水时,上端开口不需要应打开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室可用NaClO4、NH4Cl等原料制取(部分物质溶解度如图1、图2),其实验流程如图3所示,回答下列问题:
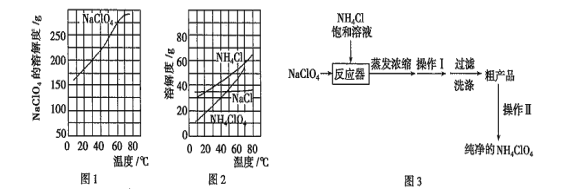
(1)反应器中发生反应的基本反应类型是____________________。
(2)上述流程中操作Ⅰ为_____,操作Ⅱ为________。
(3)已知NH4ClO4在400 ℃时开始分解为N2、Cl2、O2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略;实验开始前,已用CO2气体将整套实验装置中的空气排尽;焦性没食子酸溶液用于吸收氧气)。
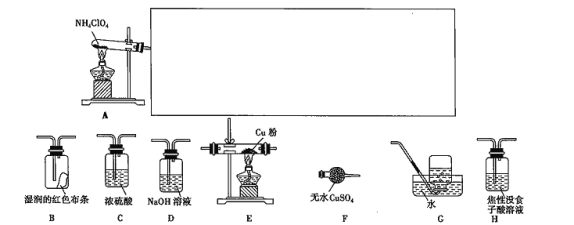
①写出高氯酸铵分解的化学方程式:_______________________。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→_______________ (填装置的字母),证明氧气存在的实验现象为__________________。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生能使湿润的红色石蕊试纸变蓝色的气体。滴加蒸馏水发生反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒的化合物常用于制催化剂和新型电池。回答下列问题:
(1) V2O5为黄褐色固体,无味、有毒,微溶于水,是许多反应的催化剂。25℃时,部分含钒微粒的存在形式、浓度及存在的pH范围之间的变化关系如图所示(其余可溶性微粒均未标出),图中“[V]”表示含钒微粒的浓度,虚线表示[V]或pH的范围尚未确定。
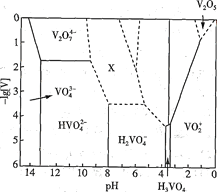
①V2O5溶于足量1.0 mol·L-1NaOH溶液中,发生反应的离子方程式为_____________________
②上述滴加H2SO4溶液的过程中,先后发生如下反应:

则“X所示区域的离子”不可能是____________(填标号)。
A.V3O93- B.V4 O103- C.V4 O124-
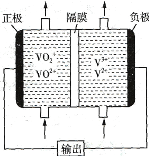
(2)如图所示为可充电的全钒液流电池构造示意图,该电池中的隔膜只允许H+通过。电池放电时,负极区溶液的pH将_________ (填“增大”“减小”或“不变”),电池充电时,阳极的电极反应式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种非常重要的有机化工原料,用途十分广泛.根据所学内容填空。
I.由乙烯合成乙酸乙酯的流程如下;
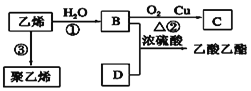
(1)写出B与D反应的化学方程式________;反应类型:_________;
(2)写出反应③的化学方程式:_________。
II.实验室用如图所示装置制备乙酸乙酯.
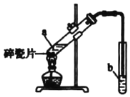
(1)实验前,向试管a中加入3mL______,然后边振荡试管边慢慢加入2mL______和2mL乙酸。
(2)试管b中盛放的试剂是饱和_____溶液。试管b中的导管不能伸入液面下的原因是____。
(3)反应结東后,从试管b中分离出乙酸乙酯的方法是______。
(4)下列描述不能说明乙醇与乙酸的反应已达到化学平衡状态的有_____(填序号)。
a.单位时间里,生成lmol乙酸乙酯,同时生成lmol水
b.单位时间区,生成lmol乙酸乙酯,同时生成1mol乙酸
c.单位时间里,消耗lmol乙醇,同时消耗1mol乙酸
d.正反应的速率与逆反应的速率相等
e.混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中的许多现象或应用都与化学知识有关。下列现象成应用与胶体性质无关的是( )
A. 将盐卤或石青加人豆浆中,制成豆腐
B. 冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用
D. 胶体、溶液和浊液这三种分散系的根本区别是分散质粒子直径的大小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com