
【题目】某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。B.在洗净的试管里配制银氨溶液。C.沿试管壁加入乙醛稀溶液。D.加热。请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目是___。
(2)简述银氨溶液的配制过程:___。
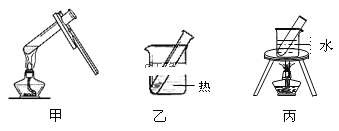
(3)步骤D应选择的加热方法是___(填下列装置编号),理由是___。
(4)乙醛发生银镜反应的化学方程式___。
(5)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
1 | 1 | 3 | 65 | 11 | 5 |
2 | 1 | 3 | 45 | 11 | 6.5 |
3 | 1 | 5 | 65 | 11 | 4 |
①实验1和实验2,探究的是___。
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为50℃,反应混合液pH为11时,出现银镜的时间___。(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成银镜的___。
(6)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。实验室从反应后的废液中回收银的实验流程如下:

已知:[Ag(NH3)2]![]() 在溶液中存在平衡:[Ag(NH3)2]+
在溶液中存在平衡:[Ag(NH3)2]+![]() Ag
Ag![]() +2NH3。
+2NH3。
①写出废液与稀HNO3反应的离子方程式___。
②加入的铁粉要过量的目的是___。
③该实验过程中可能产生的大气污染物是___。
【答案】去除试管内壁的油污,保证试管洁净 在洁净的试管里加入1mL2%的AgNO3溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止 乙 加热时试管抖动或试管中液体沸腾都将影响银镜产生的效果 CH3CHO +2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O 温度对反应速率的影响 5~6.5 min 光亮程度 [Ag(NH3)2]
CH3COONH4+2Ag↓+3NH3+H2O 温度对反应速率的影响 5~6.5 min 光亮程度 [Ag(NH3)2]![]() +OH
+OH![]() +3H
+3H![]() =Ag
=Ag![]() +2NH4++H2O 使溶液中的Ag
+2NH4++H2O 使溶液中的Ag![]() 全部还原 NO
全部还原 NO
【解析】
(1)若试管壁上沾有油污,反应生成的银难以附着在试管壁上,容易造成脱落,所以步骤A中加NaOH溶液振荡,加热煮沸。
(2)配制银氨溶液时,注意硝酸银溶液与氨水的滴加顺序,否则难以达到应有的效果。
(3)加热时,用50~60℃的水浴,且溶液要处于相对静止状态,否则很难生成光亮的银镜。
(4)乙醛发生银镜反应时,乙醛与银氨溶液在水浴加热的条件下反应,生成银镜。
(5)①比较实验1和实验2,只有温度不同。
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为50℃,反应混合液pH为11时,出现银镜的时间应介于两个极端点之间。
③探究乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,银镜的光亮度也是很重要的指标。
(6)①废液与稀HNO3反应,主要是氢氧化二氨合银与酸中H+的反应。
②加入的铁粉,主要是将Ag+全部还原出来。
③该实验过程中可能产生的大气污染物是来自铁与硝酸的反应。
(1)步骤A中加NaOH溶液振荡,加热煮沸的目是去除试管内壁的油污,保证试管洁净;答案为:去除试管内壁的油污,保证试管洁净;
(2)配制银氨溶液时,在洁净的试管里加入1mL2%的AgNO3溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止。答案为:在洁净的试管里加入1mL2%的AgNO3溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止;
(3)甲中,温度难以控制;乙中,温度恒定,溶液处于相对静止状态,生成的银容易附着在试管内壁上;丙中,溶液沸腾,生成的银很难附着在试管壁。答案为:乙;加热时试管抖动或试管中液体沸腾都将影响银镜产生的效果;
(4)乙醛发生银镜反应时,反应的化学方程式为CH3CHO +2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O。答案为:CH3CHO +2Ag(NH3)2OH
CH3COONH4+2Ag↓+3NH3+H2O。答案为:CH3CHO +2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O;
CH3COONH4+2Ag↓+3NH3+H2O;
(5)①比较实验1和实验2,显然只能为温度。答案为:温度对反应速率的影响;
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为50℃,反应混合液pH为11时,出现银镜的时间应介于两个极端点之间。答案为:5~6.5 min;
③探究乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,银镜的光亮度也是很重要的指标。答案为:光亮程度;
(6)①废液与稀HNO3反应,离子方程式为[Ag(NH3)2]![]() +OH
+OH![]() +3H
+3H![]() =Ag
=Ag![]() +2NH4++H2O。答案为:[Ag(NH3)2]
+2NH4++H2O。答案为:[Ag(NH3)2]![]() +OHimg src="http://thumb.zyjl.cn/questionBank/Upload/2020/07/27/06/f062227a/SYS202007270602121315468436_DA/SYS202007270602121315468436_DA.003.png" width="11" height="20" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />+3H
+OHimg src="http://thumb.zyjl.cn/questionBank/Upload/2020/07/27/06/f062227a/SYS202007270602121315468436_DA/SYS202007270602121315468436_DA.003.png" width="11" height="20" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />+3H![]() =Ag
=Ag![]() +2NH4++H2O;
+2NH4++H2O;
②加入的铁粉,主要是将Ag+全部还原出来。答案为:使溶液中的Ag![]() 全部还原;
全部还原;
③该实验过程中可能产生的大气污染物是NO。答案为:NO。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】![]() 时,在某物质的溶液中,由水电离出的
时,在某物质的溶液中,由水电离出的![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.![]() 时,水的电离受到抑制
时,水的电离受到抑制
B.![]() 时,水的电离受到抑制
时,水的电离受到抑制
C.![]() 时,溶液的pH一定为a
时,溶液的pH一定为a
D.![]() 时,溶液的pH一定为
时,溶液的pH一定为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,将一定量的冰醋酸
时,将一定量的冰醋酸![]() 即无水乙酸
即无水乙酸![]() 加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是
加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是![]()
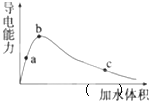
A.醋酸的电离平衡常数:![]()
B.溶液中![]() :
:![]()
C.a、b、c三点的溶液都有:![]()
D.从c点到b点,醋酸的电离度不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
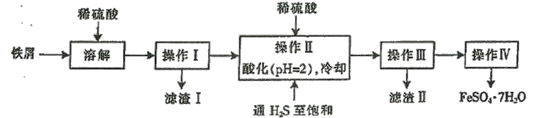
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。根据以上流程图,下列说法不正确的是
A.操作I所得滤液中不含有Fe3+
B.操作Ⅱ中用硫酸酸化至pH=2的主要目的是抑制Fe2+的水解
C.操作Ⅱ中,通入H2S至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化。
D.操作Ⅳ中所得的晶体最后用乙醇洗去晶体表面附着的水分。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 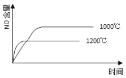
B. 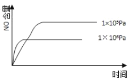
C. 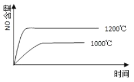
D. 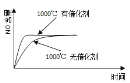
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )

A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2H2(g) + O2(g) == 2H2O(g);△H= –483.6 kJ·mol-1, H2(g) + ![]() O2(g) == H2O(l) △H=–285.8 kJ·
O2(g) == H2O(l) △H=–285.8 kJ·![]() ,由此可知,在等温下蒸发45g液态水需吸收___________kJ的热量。
,由此可知,在等温下蒸发45g液态水需吸收___________kJ的热量。
(2)工业制氢气的一个重要反应是:CO(g)+H2O(g)==CO2(g)+H2(g),已知25℃时:
C(石墨)+O2(g)==CO2(g)△H1=-394kJ·mol-1
C(石墨)+![]() O2(g)==CO(g)△H2=-111kJ·mol-1
O2(g)==CO(g)△H2=-111kJ·mol-1
H2(g)+![]() O2(g)==H2O(g)△H3=-242kJ·mol-1
O2(g)==H2O(g)△H3=-242kJ·mol-1
试计算25℃时CO(g)+H2O(g)==CO2(g)+H2(g)的△H=______kJ·mol-1
(3) 在25℃、101KPa时,___时所放出的热量,叫做该反应的燃烧热。在25℃、101KPa时,1g乙醇完全燃烧生成CO2和液态水时放热29.713kJ,则能表示乙醇燃烧热的热化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com