
【题目】![]() 时,在某物质的溶液中,由水电离出的
时,在某物质的溶液中,由水电离出的![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.![]() 时,水的电离受到抑制
时,水的电离受到抑制
B.![]() 时,水的电离受到抑制
时,水的电离受到抑制
C.![]() 时,溶液的pH一定为a
时,溶液的pH一定为a
D.![]() 时,溶液的pH一定为
时,溶液的pH一定为![]()
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ:Mo基催化剂的耐硫甲烷化反应会涉及WGS 或者RWGS 反应,主要反应式如下:
(1)CO和CO2甲烷化 CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH1=-206.2kJ/mol
CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH2=-165.0kJ/mol
写出CO 与水蒸气反应生成CO2和H2的热化学方程式__________________________________。
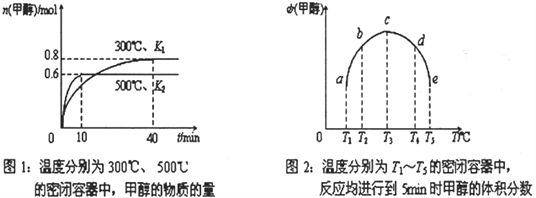
(2)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
 ,
,
①该反应的ΔH__________0 (选填“<”、“>”或“=”)。
②在500℃条件下达平衡时CO 的转化率为______________________。
③计算在300℃条件下达平衡时K=________________________。
④将容器d 中的平衡状态转变到容器c中的平衡状态,可采取的措施有______________________。
Ⅱ:某电解装置如图所示,X、Y 均为惰性电极:
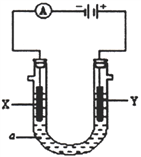
(3)若a溶液为滴有酚酞试液的NaNO3溶液,通电一段时间后X 电极及周围溶液的现象是:________________________________,Y 电极的电极反应式为______________________。
(4)若a 溶液为饱和CuCl2溶液,当电路中有0.2 mol 的电子通过时,阴、阳两电极的质量之差是__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
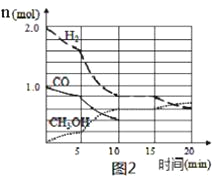
【题目】25℃时,向一定浓度的Na2C2O4溶液中滴加盐酸,混合溶液的pH与离子浓度变化关系如图所示。已知H2C2O4是二元弱酸,X表示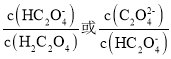 ,下列叙述错误的是
,下列叙述错误的是
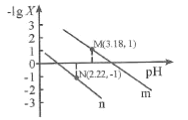
A.从M点到N点的过程中,c(H2C2O4)逐渐增大
B.直线n表示pH与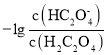 的关系
的关系
C.由N点可知Ka1 (H2C2O4)的数量级为10 -2
D.pH=4.18的混合溶液中:c(Na+)>c(HC2O4-)= c(C2O42-) =c(Cl-)> c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定体积的某NaOH溶液分成两等份,一份用![]() 的一元酸HA溶液中和,消耗酸溶液的体积为
的一元酸HA溶液中和,消耗酸溶液的体积为![]() ;另一份用
;另一份用![]() 的一元酸HB溶液中和,消耗酸溶液体积为
的一元酸HB溶液中和,消耗酸溶液体积为![]() ,则下列叙述正确的是
,则下列叙述正确的是![]()
![]()
A.若![]() ,则说明HA的酸性比HB的酸性强
,则说明HA的酸性比HB的酸性强
B.若![]() ,则说明HA的酸性比HB的酸性弱
,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故![]() 一定等于
一定等于![]()
D.若将两种酸溶液等体积混合,混合溶液的pH一定等于2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:aA(g)+bB(g)![]() cC(g)。某化学兴趣小组研究了其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是( )
cC(g)。某化学兴趣小组研究了其他条件不变时,改变某一条件对上述反应的影响,得到下列图像(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。下列分析正确的是( )

A.如图1反应:若p1>p2,则该反应只能在高温下自发进行
B.如图2反应:此反应的ΔH<0,且T1<T2
C.如图3反应:表示t1时刻一定是使用催化剂对反应速率的影响
D.如图3反应:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii.CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
iii.CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(1)已知反应ii中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
O”表示CO的化学键)数据见表:由此计算△H2=___kJ·mol-1。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为___。
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i。图1是反应体系中CO2的平衡转化率与温度的关系曲线。

①当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反应的化学反应速率为___。
②若改充入1molCO2和3mol H2,则图1中的曲线会___(填“上移”或“下移”)。
(4)某温度下在容积为2L的密闭容器中充入1molCO和2molH2合成甲醇,发生反应ii,各组分物质的量随时间的变化情况如图2所示。
①5min至10min时速率变化的原因可能是___;
②若该反应在恒温恒压下进行,能说明该反应达到平衡状态的是___;
A.单位时间内消耗CO的浓度与生成CH3OH的浓度相等
B.混合气体的密度不变
C.CO和H2的体积分数之比不变
D.混合气体的平均相对分子质量不变
③15min时,增加反应体系中CO的物质的量(其他条件不变),至20min时反应重新达到平衡;则新加入的CO的物质的量为___mol(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.具有相同通式的有机物不一定互为同系物
B.分子组成相差一个或若干个CH2原子团的化合物一定互为同系物
C.分子式为C3H8与C6H14的两种有机物一定互为同系物
D.两个相邻同系物的相对分子质量数值一定相差14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ![]()
A.某二元酸![]() 在水中的电离方程式是:
在水中的电离方程式是:![]() ,
,![]() ;则NaHA溶液中:
;则NaHA溶液中:![]()
B.相同温度下将足量氯化银固体分别放入相同体积的①蒸馏水、②![]() 盐酸、③
盐酸、③![]() 氯化镁溶液、④
氯化镁溶液、④![]() 硝酸银溶液中,
硝酸银溶液中,![]() 为①>④=②>③
为①>④=②>③
C.常温下,某溶液的![]() ,则该物质一定是酸或强酸弱碱盐
,则该物质一定是酸或强酸弱碱盐
D.若![]() 、
、![]() 、
、![]() 分别表示常温下
分别表示常温下![]() 的电离平衡常数、
的电离平衡常数、![]() 的水解平衡常数和水的离子积常数,则三者之间的关系为
的水解平衡常数和水的离子积常数,则三者之间的关系为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。B.在洗净的试管里配制银氨溶液。C.沿试管壁加入乙醛稀溶液。D.加热。请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目是___。
(2)简述银氨溶液的配制过程:___。
(3)步骤D应选择的加热方法是___(填下列装置编号),理由是___。
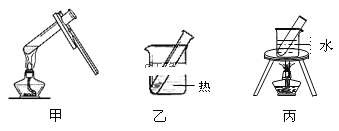
(4)乙醛发生银镜反应的化学方程式___。
(5)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
1 | 1 | 3 | 65 | 11 | 5 |
2 | 1 | 3 | 45 | 11 | 6.5 |
3 | 1 | 5 | 65 | 11 | 4 |
①实验1和实验2,探究的是___。
②当银氨溶液的量为1mL,乙醛的量为3滴,温度为50℃,反应混合液pH为11时,出现银镜的时间___。(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成银镜的___。
(6)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。实验室从反应后的废液中回收银的实验流程如下:

已知:[Ag(NH3)2]![]() 在溶液中存在平衡:[Ag(NH3)2]+
在溶液中存在平衡:[Ag(NH3)2]+![]() Ag
Ag![]() +2NH3。
+2NH3。
①写出废液与稀HNO3反应的离子方程式___。
②加入的铁粉要过量的目的是___。
③该实验过程中可能产生的大气污染物是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com